微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中属于电解质的是
A.NaCl溶液
B.CO2
C.熔融的NaOH
D.盐酸
参考答案:C
本题解析:分析:在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里或熔融状态下都不导电的化合物是非电解质,以此来解答.
解答:A.NaCl溶液是混合物,所以不是电解质,故A错误;
B.二氧化碳和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以二氧化碳的水溶液导电,但电离出离子的物质是碳酸而不是二氧化碳,所以二氧化碳是非电解质,故B错误;
C.熔融的NaOH为化合物,熔融时能导电,且在水溶液里能电离出自由移动的阴阳离子能使溶液导电,所以熔融的NaOH是电解质,故C正确;
D.盐酸为混合物,所以盐酸既不是电解质也不是非电解质,故D错误;
故选C.
点评:本题考查了电解质的判断,难度不大,注意电解质和非电解质都必须是化合物,能发生电离的为化合物本身,则选项B为易错点.
本题难度:简单
2、填空题
已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2O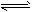 HCl+HClO,HClO
HCl+HClO,HClO H++ClO-,达平衡后,
H++ClO-,达平衡后,
(1)要使HClO浓度增加,可加入下列物质__________________(填代号)。
?A.SO2 B.Na2CO3 C.HCl D.NaOH
(2)由此说明在实验室可用排饱和食盐水收集Cl2的理由是_______________________。
参考答案:(1)B
(2)饱和食盐水中Cl-浓度较大,由于氯水中存在平衡:Cl2+H2O Cl-+HClO+H+,所以,氯气在饱和食盐水中溶解度较小,通常情况下,可用排饱和食盐水的方法收集氯气。
Cl-+HClO+H+,所以,氯气在饱和食盐水中溶解度较小,通常情况下,可用排饱和食盐水的方法收集氯气。
本题解析:
本题难度:一般
3、选择题 室温下,对于醋酸及其盐的下列判断正确的是

A.稀醋酸溶解石灰石的离子方程式为
CaCO3+2H+=Ca2++H2O+CO2↑
B.稀醋酸加水稀释后,溶液中c(CH3COO-)/c(CH3COOH)变大
C.向稀醋酸中加入等浓度的NaO H溶液,导电能力变化如右图
D.CH3COONH4溶液和K2SO4溶液均显中性,两溶液中水的电离程度相同
参考答案:B
本题解析:醋酸是弱酸,电离方程式中应写出化学式,故A错误;醋酸是弱电解质,氢氧化钠和醋酸反应生成醋酸钠,溶液中的溶质由弱电解质变成强电解质,离子浓度增大,溶液的导电能力增大,故C错误;CH3COONH4是弱酸弱碱盐,促进水的电离,醋酸根和铵根离子水解程度相同,故溶液显中性,K2SO4是强酸强碱盐,对水的电离程度没有影响,故D错误。
本题难度:一般
4、选择题 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH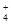 )之和
)之和