硝酸银溶液
参考答案:D
本题解析:原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加,据此分析。
该原电池中,X极逐渐变粗,Y极逐渐变细,所以Y作负极,X作正极,Y的活泼性大于X的活泼性,所以排除AC选项;X极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属,所以D符合题意。
故选D。
点评:本题考查了原电池原理,难度不大,明确正负极的判断方法,注意不能仅根据金属的活泼性判断正负极,要根据发生反应的反应类型判断正负极,如:Mg、Al、NaOH溶液构成的原电池,铝作负极,镁作正极。
本题难度:一般
2、选择题 结合右图判断,下列叙述正确的是
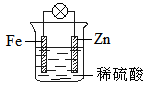
A.正极被保护
B.H+向Zn电极移动
C.加入少量KSCN溶液,变血红色
D.负极的电极反应式是:Fe-2e-=Fe2+
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铁活泼,所以锌是负极,铁是正极,溶液中的氢离子在正极得到电子,所以只有选项A正确,其余都是错误的,答案选A。
本题难度:一般
3、选择题 下列每组的三种物质中,两边的固体均有导线连接,插入中间的液体中,其中能组成原电池的是
A.Zn | H2SO4(稀) | C
B.Cu | 酒精 | Ag
C.Zn | CCl4 | Cu
D.Fe | H2SO4(稀) | Fe
参考答案:A
本题解析:
分析:根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解:A、具备原电池的构成条件,所以能组成原电池,故A正确.
B、乙醇是非电解质,且不能自发的进行氧化还原反应,故B错误.
C、四氯化碳是非电解质,且不能自发的进行氧化还原反应,故C错误.
D、两电极活泼性相同,故D错误.
故选A.
本题难度:简单
4、选择题 使用氢氧燃料电池的公共汽车已在北京街头出现.某种以30%KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下:
2H2+4OH--4e-═4H2O?O2+2H2O+4e-═4OH-.下列有关该氢氧燃料电池的说法中,正确的是( )
A.H2在正极发生氧化反应
B.供电时的总反应为:2H2+O2═2H2O
C.氢氧燃料电池中H2和O2燃烧放出的热量转变为电能
D.氢氧燃料电池不仅能量转化率高,而且产物是水,属于环境友好电池
参考答案:A、由电极反应式可知,通入氢气的一极为电池的负极,发生氧化反应,故A错误;
B、电池总反应与氢气在氧气中燃烧的化学方程式一致,供电时的总反应为2H2+O2═2H2O,故B正确;
C、氢氧燃料电池是将化学能转变为电能的装置,氢气和氧气在两极上放电,没有发生燃烧,故C错误;
D、氢氧燃料电池产物是水,对环境物污染,且能量转化率高,故D正确.
故选BD.
本题解析:
本题难度:一般
5、填空题 甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
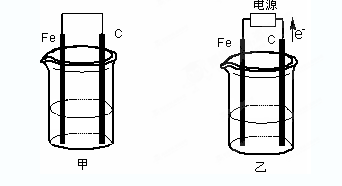
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的 棒;乙池中的 棒。
②在乙池中阳极的电极反应式是 。
(2)若两池中均盛放饱和NaCl溶液。
①写出乙池中发生总反应的离子方程式 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则溶液混匀后的pH= 。
参考答案:(1)① 碳(C );铁(Fe) (2分) ② 4OH
本题解析:
本题难度:一般
|