微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用氯气跟单质化合不能制取的物质是
A.KCl
B.FeCl2
C.FeCl3
D.CuCl2
参考答案:B
本题解析:铁在氯气中燃烧生成的氯化铁,得不到氯化亚铁,选项B不正确,其余选项都是正确的,答案选B。
点评:该题是基础性试题的考查,难度不大。该题的关键是熟练记住金属单质和氯气的反应产物,属于识记性知识的检验。
本题难度:一般
2、选择题 HClO是比碳酸还弱的酸,反应:Cl2+H2O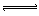 HCl+HClO达平衡后,要使HClO浓度增加,可加入?
HCl+HClO达平衡后,要使HClO浓度增加,可加入?
A.H2S(气)
B.HCl
C.CaCO3(固)
D.H2O
参考答案:C
本题解析:本题要求所加入的物质可破坏原化学平衡并增大[HClO]的浓度。
A项通入的为H2S气体是还原剂,而HClO具有氧化性,所以H2S一定会和HClO反应,故A不是答案。加入盐酸平衡向逆方向移动,也会减少HClO,故B也不是答案。加入CaCO3后CaCO3可与HCl反应,但不与HClO反应。因为三种酸的酸性由强至弱的顺序是HCl>H2CO3>HClO,所以盐酸能和碳酸钙反应,而HClO的酸性比H2CO3弱,所以不能与CaCO3反应,加入CaCO3可减小HCl浓度平衡向正方向移动而HClO不参加反应,其浓度增大。C为答案。加入水后,化学平衡虽能向正反应方向移动。但加水后溶液冲稀,HClO浓度也减小。
本题难度:一般
3、判断题 用氯气消毒的饮用水,会使水中的有机物发生氯化反应,生成有机含氯化合物,对人体有害,世界环保联盟建议推广采用高效氧化剂二氧化氯(ClO2)消毒。
(1)使用ClO2作饮用水消毒剂的优点是_____________________________。
(2)目前国外多用NaClO3与浓HCl反应制取ClO2,同时有Cl2生成,且体积为ClO2的一半,写出反应的化学方程式。__________________________________________________
(3)上述反应中产生0.1 mol Cl2,转移的电子的物质的量为_________ mol。
(4)在H2SO4酸性条件下,用Na2SO3还原NaClO3可制得ClO2,反应为:2NaClO3+Na2SO3 +H2SO4====2ClO2↑+2Na2SO4+H2O
这种方法的优点是____________________________________________________________。
参考答案:(1)高效低毒
(2)2NaClO3+4HCl(浓)====Cl2↑+2ClO2↑+2NaCl+2H2O
(3)0.2
(4)不产生有毒气体Cl2
本题解析:此题为学科内综合试题,利用学过的知识迁移重组,即可做答。
(1)问题干中已给出答案。
(2)问根据氧化还原反应规律可写出方程式,并用化合价升降法可配平。
(4)问中比较两方程式,可得出两反应的优缺点。
本题难度:简单
4、实验题 (12分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/L的NaOH溶液中得到漂水。某同学在 实验室利用下述实验装置探究Cl2性质并模拟制备漂水。
实验室利用下述实验装置探究Cl2性质并模拟制备漂水。
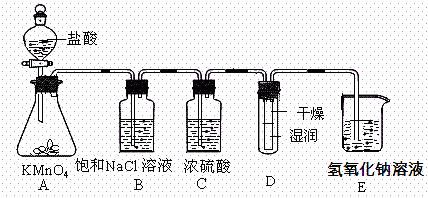
(1)配制470mL物质的量浓度为0.375 mol/L的NaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和?。
(2)浓硫酸的作用是______________________。
(3)装置E中发生反应的离子方程式为____________________________________ __。
__。
(4)装置B中饱和NaCl溶液可用于除去Cl2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述用饱和NaCl溶液除去Cl2中HCl气体的原理(用离子方程式表示,并配必要的文字说明)?
?。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所 导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_________________
导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_________________
_________________________________________。
(6)如果制得氯元素含量为10%的漂水溶液35.5g,那么其中含NaClO的物质的量为____mol。
参考答案:(12分)】
(1)500mL容量瓶(1分,不写规格不给分)
(2)干燥氯气?(2分)
(3)Cl2 + 2OH- = Cl- + ClO- + H2O?(2分)
(4)HCl溶于水电离出的H?+和饱和NaCl溶液中的Cl-都会对反应Cl2 + H2O 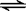 ?H?+ + Cl- + HClO 起到抑制作用?(2分)
?H?+ + Cl- + HClO 起到抑制作用?(2分)
(5)不合理;实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色;放置一段时间,由于烧杯中的水蒸气过来或纸条下端的水分子运动导致纸条上端湿润而褪色(3分)
(6)0.05(2分)
本题解析:略
本题难度:一般
5、填空题 Cl2与水作用的方程式:?。氯水是?色,说明氯水中含有的粒子:??。
参考答案:Cl2+H2O? HClO+HCl?。浅黄绿?,氯气分子
本题解析:Cl2与水作用的方程式:Cl2+H2O? HClO+HCl。氯水中因含有氯分子而使溶液显浅黄绿色;
本题难度:简单