微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (18分)推断题:
现有10种元素的性质、数据如下表所列,它们均为短周期元素。
?
| A
| B
| C
| D
| E
| F
| G
| H
| I
| J
|
原子半径(10-10m)
| 0.74
| 1.60
| 1.52
| 1.10
| 0.99
| 1.86
| 0.75
| 0.82
| 1.02
| 0.37
|
最高或最低化合价
| ?
| +2
| +1
| +5
| +7
| +1
| +5
| +3
| +6
| +1
|
-2
| ?
| ?
| -3
| -1
| ?
| -3
| ?
| -2
| ?
|
回答下列问题:
(1)D的元素名称是?,H的元素符号是?。
B在元素周期表中的位置是(周期、族)?。
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的化学式是?。
化合物F2A2的电子式是:?,构成该物质的化学键类型为?。
(3)用电子式表示A的最简单氢化物的形成过程:??;G的气态氢化物的结构式为?。
(4)一定条件下,IA2气体与足量的气体A2充分反应生成20gIA3气体,放出24.6 kJ热量,写出其热化学方程式??。
参考答案:(1)磷(2分)、B(2分)、第三周期第ⅡA族?(2分)
(2)HClO4(2分)?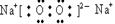 ?(2分)?离子键、非极性键(2分)
?(2分)?离子键、非极性键(2分)
(3)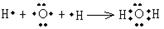 (2分)?
(2分)?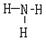 (2分)
(2分)
(4)2SO2 (g)+O2(g) 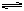 ?2SO3(g)?△H =-196.8 kJ/mol(2分)
?2SO3(g)?△H =-196.8 kJ/mol(2分)
本题解析:根据原子半径及化合物的规律,可推知A~J十种元素分别为:O、Mg、Na、P、Cl、Na、N、B、S、Li;
本题重点考查了元素周期律的应用及化学用语的书写,需要的是细心,但难度不大。详解见答案。
本题难度:一般
2、选择题 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2一具有相同的电子层结构,离子半径:Z2->W一;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是? (? )
A.W、M的某种单质可作为水处理中的消毒剂
B.电解YW2的熔融物可制得Y和W的单质
C.相同条件下,w的氢化物水溶液酸性比Z弱
D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质
参考答案:C
本题解析:Y的内层电子数是外层电子数的5倍,可得Y的内层电子总数为10,最外层电子数为2,故为镁;X+与M2一具有相同的电子层结构,故为钠和氧,由Z、M同主族可得Z为硫,根据离子半径Z2->W一得W为氯;A、单质臭氧和氯气均能用于水的消毒剂,故A正确;B、电解熔融的氯化镁可制得镁和氯气单质,B正确;W的氢化物为HCl,Z的氢化物为H2S,酸性HCl>H2S,C错误;钠和氧构成的化合物过氧化钠和水反应生成氧气,D正确;故选C。
本题难度:一般
3、选择题 下列有关物质性质的比较正确的为 ( )
①同主族元素的单质从上到下,非金属性减弱,熔点增高
②元素的最高正化合价在数值上等于它所在的族序数
③同周期主族元素的原子半径越小,越难失去电子
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Cl->Br-
⑥酸性:HClO4>H2SO4>H3PO4>H2SiO3
A.①③
B.②④
C.③⑥
D.⑤⑥
参考答案:C
本题解析:可以用反例排除;①第IVA族中C的熔点最高;②中氧元素无最高正价+6;④F元素非金属性最强,但其气态氢化物水溶液是弱酸;⑤还原性:S2->Br->Cl-;故答案为C
本题难度:一般
4、选择题 下列关于卤素(用X表示)的叙述正确的是( )。
A.其单质都能与水反应,通式为X2+H2O=HX+HXO
B.HX易溶于水,其水溶液都是强酸
C.其单质都有颜色,都有毒
D.最高价含氧酸的通式为HXO4
参考答案:C
本题解析:本题考查卤素及有关化合物的基本知识规律,解答好本题,除掌握一般规律外,要注意F2及氟的化合物的特殊性:①F2与水反应置换H2O中的氧生成O2,不像其他卤素单质,②F是最强的非金属,在化合物中不表现正价,HF的溶液表现弱酸性。
本题难度:一般
5、选择题 下列说 法中错误的是
法中错误的是
A.熔融状态下能够导 电的化合物中一定存在离子键
电的化合物中一定存在离子键
B.单原子形成的离子,一定与稀有气体原子的核外电子排布相同
C.L层上的电子数为奇数的原子一定是主族元素的原子
D.同一主族的元素的原子,最外层电子数相同,化学性质不一定完全相同
参考答案:B
本题解析:略
本题难度:一般