微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某强酸性溶液X中含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取该溶液进行连续实验,能实现如下转化:

根据以上信息,请回答下列问题:
(1)溶液X中除H+外肯定含有的离子是?,不能确定是否含有的离子是?,若要确定不能确定的阳离子是否存在,最可靠方法是:?
?。
(2)沉淀E的化学式为?。
(3)反应①、②、③、④中,属于氧化还原反应的是?(填序号)
(4)写出步骤①中生成气体A的离子方程式:?。
参考答案:
(1)Al3+、NH4+、Fe2+、SO42-;Fe3+;取少量X溶液于试管中,加入几滴KSCN溶液,溶液颜色变红,则证明含有Fe3+,若不变红,则表明不含Fe3+。
(2)Fe(OH)3
(3)①
(4)3Fe2++NO3-+4H+=3Fe3++NO↑+H2O
本题解析:某强酸性溶液可以排除掉SiO32-、CO32-的存在,加入过量的硝酸钡沉液产生气体A和沉淀B,可以确定一定含有SO42-、Fe2+,一定不含有NO3-,加入过量的氢氧化钠能产生气体,可以确定一定含有NH4+。
本题难度:一般
2、选择题 能正确表示下列反应的离子反应方程式的是
A.Na2O2?溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.将铝粉加入到NaOH溶液中溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
D.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
参考答案:C
本题解析:分析:A.原子不守恒;
B.恰好使SO42-沉淀完全,1:2反应,生成硫酸钡、偏铝酸钾;
C.反应生成偏铝酸钠和氢气;
D.反应生成氢氧化铜、氢气.
解答:A.Na2O2?溶于水产生O2的离子反应为2Na2O2+2H2O═4Na++4OH-+O2↑,故A错误;
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全的离子反应为Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O,故B错误;
C.将铝粉加入到NaOH溶液中溶液中的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故C正确;
D.钠与CuSO4溶液反应的离子反应为2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑,故D错误;
故选C.
点评:本题考查离子反应方程式的书写,明确离子反应的实质、离子反应中保留化学式的物质是解答本题的关键,注意选项D中不能发生置换反应,题目难度不大.
本题难度:困难
3、选择题 1?L某混合溶液中,溶质X、Y浓度都为0.1mol·L-1,向混合溶液中滴加 0.1?mol/L某溶液Z,所得沉淀的物质的量如图所示,则X、Y、Z分别是
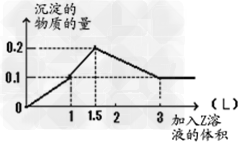
[? ]
A.偏铝酸钠、氢氧化钡、硫酸?
B.氯化铝、氯化镁、氢氧化钠
C.氯化铝、氯化铁、氢氧化钠?
D.偏铝酸钠、氯化钡、硫酸
参考答案:A
本题解析:
本题难度:一般
4、填空题 某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SiO32-、SO42-、NO3-中的一种或几种离子。为确定溶液X的成分,进行如下实验:
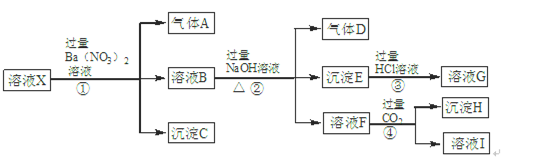
根据以上信息,请回答下列问题:
(1)溶液X中肯定不含有的离子是?,不能确定是否含有的离子是?,若要确定是否含有这种离子,最可靠方法是:?
?。
(2)溶液I中所含溶质有?(填化学式)。
(3)步骤①②③④中,发生符合“强酸制弱酸”反应的步骤是?(填序号)。
(4)步骤①中生成气体A的离子方程式是?。
参考答案:(1)Ba2+、CO32-、SiO32-、NO3- (每个1分,共4分)?Fe3+(1分)
取少量X溶液于试管中,在其中滴加几滴KSCN溶液,若溶液不显血红色则说明没有Fe3+,若显血红色则说明含有Fe3+(2分)
(2)NaNO3、NaHCO3、Ba(NO3)2?(CO2、H2CO3不作要求)(每个1分,共3分) ?
(3)④(1分)?(4)3Fe2++NO3- +4H+=3Fe3++NO↑+2H2O (2分)
本题解析:(1)题干中强酸性溶液中一定不含CO32-、SiO32-;NO3-与Fe2+不能同时存在;根据转化关系中X溶液中加入过量硝酸钡生成气体沉淀和溶液的反应,依据离子性质推断溶液中一定含Fe2+,一定不含NO3?;酸性溶液中硝酸根离子具有强氧化性,加入Ba(NO3)2后得到气体A为NO,D为NO2;沉淀C为硫酸钡,判断溶液中一定含SO42-;根据离子共存判断原溶液中一定不含Ba2+;溶液B中一定含有Fe3+;B溶液和过量氢氧化钠反应生成气体、沉淀、溶液,推断原溶液中一定含NH4+;生成的沉淀E是Fe(OH)3;与碱反应生成的气体D为NH3;溶液F通入过量二氧化碳生成沉淀,判断溶液H中含有AlO2-;证明原溶液中一定含有Al3+;沉淀H为Al(OH)3;原溶液中一定含有Al3+、NH4+、Fe2+、SO42-;一定不含Ba2+、CO32-、SiO32-、NO3-;可能含有的Fe3+;用KSCN溶液可检验是否含有Fe3+。
(2)溶液F加入过量的CO2得到的溶液I,一定含有生成的NaHCO3、第①②步剩余和生成的NaNO3和Ba(NO3)2。
(3)①为Ba2+与SO42?反应、NO3?和H+氧化Fe2+;②NaOH与NH4+和Fe3+反应;③为Fe(OH)3与HCl的反应;④为CO2、H2O与AlO2-生成Al(OH)3的反应,所以符合“强酸制弱酸”反应为④。
(4)步骤①中生成气体A为NO3?、H+氧化Fe2+,配平可得离子方程式:)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 。
本题难度:一般
5、选择题 常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为:①>②>③
B.向饱和氯水中加入NaOH溶液至pH=7,所得溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 KHC2O4溶液中:c(OH-)=c(H+) +c(H2C2O4)-2c(C2O42-)
D.等物质的量浓度Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)< c(H+)+c(HCO3-)+3c(H2CO3)
参考答案:D
本题解析:试题分析: A、酸性CH3COOH>H2CO3>HCO3-,所以同浓度溶液的碱性:CH3COONa<Na2CO3,pH均为9的三溶液,物质的量浓度CH3COONa最大、NaOH最小,错误;B、饱和氯水中加入氢氧化钠溶液至中性,c(ClO-)<c(Cl-),错误;C、KHC2O4溶液电荷守恒式为c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-)、物料守恒式为c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),所以c(OH-)=c(H+) +c(H2C2O4)-c(C2O42-),错误。D、等浓度、等体积碳酸钠与碳酸氢钠溶液混合,电荷守恒式为c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)、物料守恒式为2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)],消去c(Na+)得:2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+),因溶液呈碱性,c(OH-)>c(H+),所以c(CO32-)+c(OH-)< c(H+)+c(HCO3-)+3c(H2CO3),正确。
考点: 离子浓度比较
本题难度:一般