微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,对二氧化硫的排放有了大大的改善。已知SO2可以用Fe( NO3)3溶液吸收, 0.1mol/L的Fe(NO3)3溶液的pH=2。某学习小组据此展开如下相关探究:
【探究I】铜与浓硫酸的反应探究:
(l)取12.8g铜片于三颈烧瓶中,通N2一段时间后再加入20 mL 18 mol?L-1的浓硫酸,加热。装置A中有白雾(硫酸酸雾)生成,装置B中产生白色沉淀,充分反应后,烧瓶中仍有铜片剩余。

①该小组同学认为烧瓶中除有铜片剩余外还应有较多的硫酸剩余,其原因是: ___________________?。
②该小组同学欲通过测定产生气体的量来求余酸的物质的量,设计了多种实验方案。下列方案不可行的是______?。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量硫酸酸化的高锰酸钾溶液后,再加入足量的BaCl2溶液,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
【探究II】装置B中产生沉淀的原因探究:
(2)加入浓硫酸之前先通N2一段时间,其目的是____?。
(3)经过讨论,该小组对装置B中产生沉淀的原因,提出下列猜想(不考虑各因素的叠加):
猜想1: 装置A中的白雾进入B参与反应
猜想2:SO2被Fe3+氧化为SO42-
猜想3:?。
(4)甲同学认为只要在装置A、B间增加洗气瓶C,就可以排除装置A中白雾影响,则C中盛放的试剂是?。
(5)乙同学取出少量装置B中清液,加入几滴酸性高锰酸钾,发现紫红色褪去,据此认为猜想2成立。你是否同意其结论?并说明理由:?。
【思考与交流】
(6)实验结束后,若使烧瓶中铜片继续溶解,下列方案(必要时可加热)可行的是?。
A.打开弹簧夹,通入O2? B.由分液漏斗加入H2O2溶液
C.由分液漏斗加入NaNO3溶液?D.由分液漏斗加入Na2SO4溶液
参考答案:(1)①随着反应进行,硫酸变稀,与铜片不反应?②A B
(2)排除空气的干扰
(3)酸性条件下,SO2被NO3-氧化为SO42-
(4)NaHSO3饱和溶液
(5)不同意;溶解的SO2也能使酸性高锰酸钾溶液褪色
(6)A B C
本题解析:(1)①Cu只与浓硫酸发生反应。随着反应的进行硫酸变为稀硫酸,就与铜片不反应。所以烧瓶中除有铜片剩余外还应有较多的硫酸剩余。②A.发生在加热条件下进行。所以产生的气体除了有SO2外,还有水蒸汽,因此缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重称量的质量是SO2和水蒸汽的质量和。无法计算剩余硫酸的质量。错误。B.高锰酸钾能把SO2氧化为硫酸,由于是用硫酸酸化,所以再加入足量的BaCl2溶液,测量所得沉淀是SO2氧化的硫酸和加入的硫酸共同产生的硫酸钡。故不能确定SO2的多少,进而不能确定有多少硫酸没有乘积反应。错误。C.由于SO2不能在饱和NaHSO3溶液中溶解。所以可以用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)。来确定发生还原反应的硫酸的物质的量,进而可以计算出未参加反应的硫酸的物质的量。正确。选项为AB。(2)加入浓硫酸之前先通N2一段时间,其目的是驱赶装置中的空气,排除空气的干扰。(3)根据题意可知:猜想3是酸性条件下,SO2被NO3-氧化为SO42-。(4)甲同学认为只要在装置A、B间增加洗气瓶C,就可以排除装置A中白雾影响,则C中盛放的试剂应该只吸收SO3但是不溶解或反应消耗SO2,可以是NaHSO3饱和溶液。(5)乙同学取出少量装置B中清液,加入几滴酸性高锰酸钾,发现紫红色褪去,据此认为猜想2成立这种认识是错误的、不同意;因为溶解的SO2也能使酸性高锰酸钾溶液褪色。 (6)A 通入氧气,发生反应:2Cu+ O2 2CuO;CuO + H2SO4= CuSO4 + H2O.正确。B由分液漏斗加入H2O2溶液H2O2加热分解产生氧气,作用同A。正确。C由分液漏斗加入NaNO3溶液。在酸性条件下发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。Cu溶解。正确。D.由分液漏斗加入Na2SO4溶液不会发生任何反应。错误。因此选项为A B C。2的性质及检验的知识。
2CuO;CuO + H2SO4= CuSO4 + H2O.正确。B由分液漏斗加入H2O2溶液H2O2加热分解产生氧气,作用同A。正确。C由分液漏斗加入NaNO3溶液。在酸性条件下发生反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。Cu溶解。正确。D.由分液漏斗加入Na2SO4溶液不会发生任何反应。错误。因此选项为A B C。2的性质及检验的知识。
本题难度:困难
2、选择题 下列关于SO2性质的分析,肯定错误的是
A.通入Ca(ClO)2溶液中,有HClO生成
B.通入FeCl3溶液中,有SO42-生成
C.通入氯水中,有淡黄色沉淀生成
D.通入KICl2溶液中,有I-生成
参考答案:C
本题解析:A、Ca(ClO)2+SO2(少量)+H2O=CaSO4↓+HCl+HClO;Ca(ClO)2+2SO2(过量)+2H2O=CaSO4↓+2HCl+H2SO4 ;通入Ca(ClO)2溶液中,可能有HClO生成,故A正确; B、二氧化硫通入FeCl3溶液中,发生反应,2Fe3++SO2+H2O=2Fe2++4H++SO42-,有SO42-生成,故B正确; C、通入氯水中反应,Cl2+SO2+2H2O=H2SO4+2HCl,无淡黄色沉淀生成,故C错误; D、二氧化硫气体通入KICl2溶液中,二氧化硫具有还原性,被KICl2氧化为硫酸,本身被还原为I-,故D正确;故选C.
本题难度:一般
3、填空题 兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
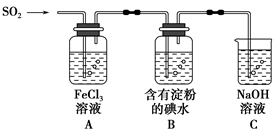
(1)SO2气体还原Fe3+的产物是________(填离子符号),参加反应的SO2和Fe3+的物质的量之比是________。
(2)下列实验方案适用于在实验室制取所需SO2的是________。
A.Na2SO3溶液与HNO3?B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧?D.铜与热浓H2SO4
(3)装置C的作用是________________________________________________。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有________(填序号)。
A.蒸发皿 ? B.石棉网? C.漏斗? D .烧杯
E.玻璃棒?F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液中加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液中加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是________,原因是________________________________
(6)能表明I-还原性弱于SO2的现象是________________________________
参考答案:(1)Fe2+和SO42— 1∶2 (2)BD (3)吸收多余的SO2,防止污染空气 (4)BF (5)方案① SO2也能使酸性KMnO4溶液褪色 (6)B中溶液蓝色变淡甚至消失
本题解析:(1)SO2+2Fe3++2H2O=SO42—+2Fe2++4H+
(2)实验室制SO2:
Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O或Cu+2H2SO4(浓)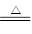 ?CuSO4+SO2↑+2H2 O;HNO3能氧化SO2,固体硫在纯氧中燃烧生成的SO2中混有O2。
?CuSO4+SO2↑+2H2 O;HNO3能氧化SO2,固体硫在纯氧中燃烧生成的SO2中混有O2。
(3)SO2有毒,须用碱液吸收。
(4)蒸发用到的仪器为:蒸发皿、玻璃棒、酒精灯、铁架台;过滤用到的仪器为:铁架台、漏斗、玻璃棒、烧杯。
本题难度:一般
4、选择题 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是

A.洗气瓶中没有看到明显现象
B.气体X是纯净物
C.洗气瓶中产生的沉淀是碳酸钡
D.Z导管口有红棕色气体出现
参考答案:D
本题解析:C+2H2SO4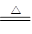 CO2↑+2SO2↑+2H2O 即:X为CO2和SO2混合气体;
CO2↑+2SO2↑+2H2O 即:X为CO2和SO2混合气体;
Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O 即Y为NO2
按题意,将三气体通入氯化钡溶液后:
NO2+SO2=NO+SO3? SO3+H2O=H2SO4? H2SO4+BaCl2=BaSO4↓+2HCl
可知:反应后的溶液呈强酸性,得到不溶于酸的BaSO4沉淀,但不能得到可溶于酸的BaSO3、BaCO3;同时CO2在强酸性溶液中不能存在,和NO一起逸出,而NO在瓶口可被氧化为NO2,而呈现红棕色
本题难度:一般
5、选择题 实验室常采用点滴板来完成部分实验,既可节约药品,又便于观察实验现象。图中所示的实验现象描述正确的是(?)

①装有铜片的孔穴中溶液呈蓝色
②装有胆矾的孔穴中固体的颜色变浅
③装有铁片的孔穴中溶液呈浅绿色
④装有铁片的孔穴中溶液呈浅黄色
⑤装有蛋清溶液的孔穴中溶液呈黄色
A.①④
B.②③
C.①⑤
D.②⑤
参考答案:D
本题解析::①浓硫酸与铜在加热条件下反应,不加热无现象,故①错误;②浓硫酸具有吸水性,可使胆矾失去结晶水,颜色变浅,故②正确;③浓硝酸具有强氧化性,在常温下与铁发生钝化,不能观察到绿色,故③错误;④浓硝酸具有强氧化性,在常温下与铁发生钝化,不能观察到黄色,故④错误;⑤浓硝酸与蛋白质发生显色反应,蛋白质变黄,故⑤正确.故选D.
本题难度:一般