微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。有关说法正确的是

A.a、b、c三点溶液的pH:a>b>c
B.若使C点的醋酸根离子浓度增大,溶液的pH也增大,可加入适量的醋酸钠固体
C.a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D.用湿润的pH试纸测量c处溶液的pH值,比实际pH值偏小
参考答案:B
本题解析:略
本题难度:一般
2、填空题 (6分)在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答:
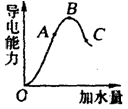
(1)“O”点导电能力为“0”的理由是 。
(2)A、B、C三点pH由大到小的顺序是__________________。
(3)A、B、C三点电离度最大的是_____________。
参考答案:(6分)⑴冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。
(2)C>A>B (3)C
本题解析:
⑴溶液的导电能力与溶液中离子浓度和离子所带电荷有关,冰醋酸只有在水溶液中电离,“O”点时为纯醋酸,难电离,可视为不导电。⑵由图可以确定溶液中H+浓度由小到大的次序为C、A、B,pH由大到小的顺序是C>A>B;⑶溶液越稀电离程度越大,C点电离度最大。
本题难度:一般
3、选择题 室温下向10 mL pH = 3的醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中C(CH3COO-)/C(CH3COOH).c(OH-)不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10 mL pH = 11的NaOH溶液,混合液pH=7
参考答案:B
本题解析:醋酸属于弱酸,加水稀释有利于醋酸的电离,所以醋酸的电离程度增大,同时溶液中导电粒子的数目会增大,由于溶液体积变化更大,所以溶液的酸性会降低,即c(H+)、c(CH3COO-)、c(CH3COOH)均会降低,因此选项A、C均不正确;由水的离子积常数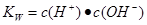 知
知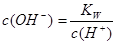 ,所以
,所以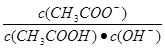 =
=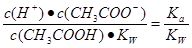 其中
其中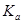 表示醋酸的电离平衡常数,由于水的离子积常数和醋酸的电离平衡常数均只与温度有关,所以选项B正确;pH=3的醋酸说明醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液说明氢氧化钠的浓度等于0.001mol/L,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,溶液显酸性,D不正确,答案选B。
表示醋酸的电离平衡常数,由于水的离子积常数和醋酸的电离平衡常数均只与温度有关,所以选项B正确;pH=3的醋酸说明醋酸的浓度大于0.001mol/L,pH=11的NaOH溶液说明氢氧化钠的浓度等于0.001mol/L,因此加入等体积的pH=11的NaOH溶液时,醋酸会过量,溶液显酸性,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。主要是考查学生对弱电解质电离平衡以及影响电离平衡因素的熟悉了解程度,有利于培养学生的逻辑推理能力和创新思维能力。明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化程度是解答本题的关键。
本题难度:一般
4、选择题 有0.1mol?L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
A.溶液①中,c(CH3COO-)=c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)=c(H+),故A错误;
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,浓度越小,醋酸根离子浓度越小,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO-),故B错误;
C.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),故C正确;
D.溶液①、③等体积混合,醋酸的电离程度大于醋酸根离子水解程度,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),故D错误;
故选C.
本题解析:
本题难度:简单
5、填空题 结合下表回答下列问题(均为常温下的数据):
酸
| 电离常数(Ka)
| 酸
| 电离常数(Ka)
|
CH3COOH
| 1.8×10-5
| H2CO3
| K1=4.4×10-7
K2=4.7×10-11
|
HClO
| 3×10-8
|
(1)上述三种酸中,酸性最强的是 。
(2)在常温下,相同物质的量浓度的①CH3COONa、 ②Na2CO3、③NaClO三种溶液的pH由小到大的顺序为 。(用序号回答)
(3)设计一个现象明显、操作简便的实验方案证明CH3COOH酸性强于碳酸(不用叙述仪器和具体操作) 。
(4)向Na2CO3溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的钠盐,同时还有另两种钠盐生成,该反应的化学方程式为 。
(5)实验证明:向0.01 mol/L NaAlO2溶液中加入等体积0.01 mol/L NaHCO3溶液,会产生白色胶状沉淀。据此推断CO32-和AlO2-两种离子中,结合质子(H+)能力较强的是 。
参考答案:(10分)(1)CH3COOH(1分) (2)①<③<②(2分)
(3)用醋酸溶液与碳酸氢钠(或其它碳酸盐)反应,有无色气体产生,从而证明醋酸酸性强于碳酸。(其它合理答案也可)(2分)
(4)2Na2CO3+Cl2+H2O=2NaHCO3+NaCl+ NaClO(3分) (5)AlO2-(2分)
本题解析:(1)酸越强,相应的电离平衡常数越大。根据表中数据可知,醋酸的电离平衡常数最大,所以上述三种酸中,酸性最强的CH3COOH。
(2)酸越弱,相应的钠盐越容易水解,溶液的碱性越强。根据电离平衡常数可知,酸性强弱顺序是CH3COOH>H2CO3>HClO>HCO3-,所以相同物质的量浓度的①CH3COONa、②Na2CO3、③NaClO三种溶液的pH由小到大的顺序为①<③<②。
(3)要证明醋酸的酸性强于碳酸,则可以利用较强酸制备较弱酸来完成,所以正确的方法是用醋酸溶液与碳酸氢钠(或其它碳酸盐)反应,有无色气体产生,从而证明醋酸酸性强于碳酸。
(4)向Na2CO3溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的钠盐,同时还有另两种钠盐生成。由于碳酸的酸性强于次氯酸,但次氯酸酸性强于HCO3-,所以氯气通入到碳酸钠溶液中生成碳酸氢钠、氯化钠和次氯酸钠,反应的化学方程式为2Na2CO3+Cl2+H2O=2NaHCO3+NaCl+ NaClO。
(5)向0.01 mol/L NaAlO2溶液中加入等体积0.01 mol/L NaHCO3溶液,会产生白色胶状沉淀,该白色沉淀一定是氢氧化铝。由于碳酸氢钠溶液中存在HCO3-的电离平衡HCO3- H++CO32-,而AlO2-可以结合HCO3-电离出的氢离子生成氢氧化铝沉淀和CO32-,由此可知CO32-和AlO2-两种离子中,结合质子(H+)能力较强的是AlO2-。
H++CO32-,而AlO2-可以结合HCO3-电离出的氢离子生成氢氧化铝沉淀和CO32-,由此可知CO32-和AlO2-两种离子中,结合质子(H+)能力较强的是AlO2-。
考点:考查弱电解质的电离、盐类水解、溶液中离子浓度大小比较以及离子反应的有关判断和应用
本题难度:困难