微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度(mol/L)
| 0.0010
| 0.0100
| 0.0200
| 0.1000
| 0.2000
|
pH
| 3.88
| 3.38
| 3.23
| 2.88
| 2.73
|
?
回答下列问题:
(1)写出醋酸的电离方程式:?。
(2)醋酸溶液中存在的微粒有?。
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是?。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度(填增大、减小或不变)?。
参考答案:(1)CH3COOH? ?CH3COO- ?+? H+?(2分)
?CH3COO- ?+? H+?(2分)
(2)H2O,? CH3COOH,? CH3COO- ?,? H+? , OH-?(3分,少一个扣1分,)
(3)当醋酸浓度为0.001mol/L 时,溶液中的氢离子浓度小于0.001mol/L(3分)(其他合理即可)
(4)增大(2分)
本题解析:
(1)CH3COOH是弱电解质,? CH3COOH? ?CH3COO- ?+? H+?
?CH3COO- ?+? H+?
(2)醋酸溶液中存在醋酸和睡得部分电离,所以存在以下微粒:H2O,? CH3COOH,? CH3COO- ?,? H+? , OH-
(3)当醋酸浓度为0.001mol/L 时,溶液中的氢离子浓度小于0.001mol/L,发生部分电离,为弱电解质。
(4)增大
本题难度:一般
2、简答题 下列实验操作及对实验事实的描述错误的是______(填编号).
A.用托盘天平称取5.5g?KCl固体
B.将干燥的pH试纸浸入某一溶液一会儿后取出,与标准比色卡比较以测定溶液pH
C.若用水润湿过的pH试纸去测pH相等的H2SO4和CH3COOH,则CH3COOH的误差更小
D.向NaOH溶液中滴加入硫酸铝溶液和向硫酸铝溶液中滴加入NaOH溶液现象不同
E.常温下,分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时,消耗的氢氧化钠溶液的体积前者少,后者多
F.c(H+)相同,体积相同的盐酸、硫酸和醋酸,分别加入足量的锌,相同状况下产生的气体的体积最大的是醋酸.
参考答案:
A、托盘天平可精确到0.1g,用托盘天平可称取5.5g?KCl固体,故A正确;
B、将干燥的pH试纸浸入某一溶液一会儿后取出,会玷污溶液,正确使用方法是用玻璃棒点蘸取溶液点试纸的中部与标准比色卡比较,故B错误;
C、用水润湿相当于稀释,则所测的PH偏小,由于稀释会促进弱电解质的电离,故弱酸的PH误差小,故C正确;
D、向NaOH溶液中滴加入硫酸铝溶液,先生成偏铝酸钠后生成氢氧化铝沉淀,故现象是:开始无明显变化后出现沉淀.向硫酸铝溶液中滴加入NaOH溶液,先生成氢氧化铝沉淀,后沉淀溶解生成偏铝酸钠,故现象为先出现沉淀后溶解.故D正确;
E、由于醋酸部分电离,故醋酸消耗碱多,故E正确;
F、由于醋酸部分电离,故醋酸产生的气体多,故F正确;
故选B.
本题解析:
本题难度:一般
3、选择题 有常温下物质的量浓度均为0.1 mol/L的①氨水②NH4Cl溶液③Na2CO3溶液?④NaHCO3溶液,下列说法正确的是(?)
A.4种溶液pH的大小顺序:①>④>③>②
B.等体积的①和②溶液混合后若pH>7:c(Cl-)>c(N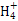 )
)
C.溶液①、③由水电离产生的c(OH-):①<③
D.溶液③、④等体积混合后,溶液中c(C )>c(HC
)>c(HC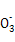 )
)
参考答案:C
本题解析:Na2CO3水解程度大于NaHCO3,碱性强,故4种溶液pH的大小顺序:①>③>④>②,A错;根据溶液电中性:c(N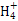 )+c(H+)=c(Cl-)+c(OH-),由溶液的pH>7,可知c(H+)<c(OH-),故c(N
)+c(H+)=c(Cl-)+c(OH-),由溶液的pH>7,可知c(H+)<c(OH-),故c(N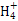 )>c(Cl-),B错;Na2CO3水解促进水的电离,NH3·H2O电离抑制水的电离,故水电离产生的c(OH-):①<③,C对;③、④等体积混合后以C
)>c(Cl-),B错;Na2CO3水解促进水的电离,NH3·H2O电离抑制水的电离,故水电离产生的c(OH-):①<③,C对;③、④等体积混合后以C 的水解为主,且C
的水解为主,且C 水解生成HC
水解生成HC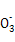 ,故溶液③、④等体积混合后,溶液中c(C
,故溶液③、④等体积混合后,溶液中c(C )<c(HC
)<c(HC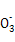 ),D错。
),D错。
本题难度:一般
4、选择题 用蒸馏水逐步稀释0.2mol/L的稀氨水时,若温度不变,在稀释过程下列数据始终保持增大趋势的是( )
A.c(OH-)
B.c(NH4+)
C.c(NH3?H2O)
D.c(NH4+)/c(NH3?H2O)
参考答案:A.加水稀释氨水,促进氨水电离,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,故A错误;
B.加水稀释氨水,促进氨水电离,n(NH4+)增大,但溶液的体积增大的多,则c(NH4+)减小,故B错误;
C.加水稀释氨水,促进氨水电离,n(NH3.H2O)减少,溶液的体积增大,所以C(NH3.H2O)减少,故C错误;
D.加水稀释氨水,促进氨水电离,溶液中c(NH4+)和C(NH3.H2O)都减小,但铵根离子浓度减小的程度小于氨水浓度减小的程度,所以铵根离子浓度与氨水浓度之比增大,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 甲酸和乙酸都是弱酸,当它们的浓度均为0.1mol?L-1时,甲酸中的c(H+)约为乙酸中c(H+)的3倍。现有两种不同浓度的甲酸a和b,以及0.10 mol?L-1的乙酸。经测定它们的pH从小到大依次为a、乙酸、b。由此可知
A.a的浓度必小于乙酸的浓度
B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度
D.b的浓度必大于乙酸的浓度