微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
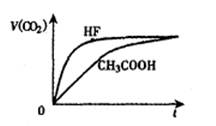
1、选择题 相同温度,浓度均为0.1mol /L,等体积的三种溶液:①HF溶液、②CH3COOH溶液、③NaHCO3溶液,已知将①、②分别与③混合,实验测得产生的CO2气体体积(v)随时间(t)的变化如右图所示,下列说法正确的是(? )
A.上述三种溶液中:c( OH-)大小:③ > ② > ①
B.物质酸性的比较:CH3COOH > HF > H2CO3
C.反应结束后所得两溶液中: c ( CH3COO- ) > c ( F- )
D.①和③反应结束后所得溶液中:c ( F- ) + c (HF) =" 0.10mol" /L
参考答案:A
本题解析:A.由于相同浓度的HF与NaHCO3反应放出CO2比CH3COOH溶液快。说明溶液的酸性HF> CH3COOH>H2CO3。溶液的酸性越强,c(H+)越大,则根据水的离子积常数可得c( OH-)就越小。因此c( OH-)大小:③ > ② > ①。正确。B. 物质酸性的比较:HF >CH3COOH > H2CO3。错误。C. 反应结束后,由于放出的CO2体积相同,所以含有的酸根离子的浓度也相等。D. ①和③反应结束后所得溶液中:c ( F- ) + c (HF)? =" 0.05mol" /L .错误。
本题难度:一般
2、选择题 对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是(?)
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10oC,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用盐酸中和,消耗的盐酸体积相同
参考答案:A
本题解析:同pH,同体积的弱碱和强碱,加入NH4Cl后,氢氧根均减小;温度降低Kw改变,pH改变。加水稀释十倍,氨水电离程度增加,pH(NH3·H2O)>pH(NaOH),n(NH3·H2O)>n(NaOH),NH3·H2O消耗的盐酸更多。
本题难度:一般
3、填空题 (15分)现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
阳离子
| H+、Na+、A13+、Ag+、Ba2+
|
阴离子
| OH—、C1—、CO32—、NO3—、SO42-
|
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。试回答下列问题:
(1)写出D为_________________
(2)将C溶液逐滴加入等体积、等物质量的浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为:_____________________。
(3)写出E溶液与过量的B溶液反应的离子方程式__________________________。
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H=-aKJ·mol-1。请写出B与C的稀溶液反应的热化学方程式______________________________
(5)在100 mL0.1 mol·L-1E溶液中,逐滴加入35 mL 2 mol·L-1NaOH溶液,最终得到沉淀物质的量为_____。
参考答案:(1)? AgNO3?(2) C(Na+) 〉C(Cl-)〉C(HCO3-)〉C(OH-)〉C(H+)
(3)2Al3+ + 3SO42- + 3Ba2+ + 8OH- ="==" 2AlO2- + 4H2O + 3BaSO4↓
(4)Ba(OH)2(aq)+ 2HCl(aq)===Ba(NO?3)2(aq)+2H2O(1);△H=-2aKJ·mol-1
(5)0.01mol
本题解析:由A、B溶液呈碱性,在所给的各种离子中,碳酸根水解显碱性,氢氧根有碱性,所以A、B中含有的阴离子为碳酸根和氢氧根,又因为铝离子和银离子水解显酸性,氢离子显酸性,所以C、D、E溶液含有的阳离子为H+、Al3+、Ag+,Na2CO3和可溶性的铝盐反应的实质是:铝离子和碳酸根离子之间双水解反应,产物既有沉淀又有气体,所以A是碳酸钠,B是氢氧化钡,碳酸钠和酸反应会产生二氧化碳气体,③在所有的阳离子和阴离子组成的物质中,硝酸银能和盐酸、氯化钠、硫酸铝、氢氧化钡反应生成沉淀,所以D是硝酸银,C是盐酸,E为硫酸铝。
(1)AgNO3
(2)两物质的发生反应:Na2CO3+HCl=NaHCO3+NaCl,由于少量水解,导致溶液呈碱性:C(Na+) 〉C(Cl-)〉C(HCO3-)〉C(OH-)〉C(H+)
(3)硫酸铝和过量的氢氧化钡反应,铝离子和硫酸根之间按照物质的量之比是2:3,即2Al3++3SO42-+3Ba2++8OH-═2AlO2-+4H2O+3BaSO4↓
(4)(3)氢氧化钡为强碱,盐酸为强酸,则B与C的稀溶液反应的热化学方程式为:
OH-(aq)+H+(aq)=H2O(1);△H=-a kJ/mol
或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1);△H=-a kJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1);△H=-2a kJ/mol
(5)35mL 2mol·L-1NaOH是0.07mol,铝离子是0.02mol,所以生成0.02mol氢氧化铝,同时消耗0.06mol氢氧化钠,剩余氢氧化钠是0.01mol,又溶解0.01mol氢氧化铝,所以最终生成氢氧化铝是0.01mol
本题难度:简单
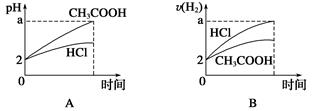
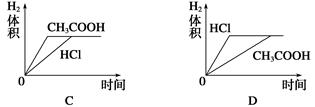
4、选择题 在体积均为1 L,pH均等于2的盐酸和醋酸中,分别投入0.12 g镁粉充分反应后,下图中比较符合反应事实的曲线是( )
参考答案:C
本题解析:镁最多失去电子的物质的量为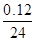 ×2=0.01 mol。A、B项,在反应过程中,CH3COOH进一步电离,CH3COOH的pH小于HCl的pH,生成氢气的速率,v(CH3COOH)>v(HCl),A、B均错;C、D项,由于Mg是定量的,HCl恰好完全反应,而CH3COOH过量,且CH3COOH与Mg反应速率快,所以C对,D错。
×2=0.01 mol。A、B项,在反应过程中,CH3COOH进一步电离,CH3COOH的pH小于HCl的pH,生成氢气的速率,v(CH3COOH)>v(HCl),A、B均错;C、D项,由于Mg是定量的,HCl恰好完全反应,而CH3COOH过量,且CH3COOH与Mg反应速率快,所以C对,D错。
本题难度:简单
5、选择题
A.醋酸与锌反应放出氢气多
B.盐酸和醋酸分别与锌反应放出的氢气一样多
C.醋酸与锌反应速率大
D.盐酸和醋酸分别与锌反应的速率一样大
参考答案:BC
本题解析:pH相同的盐酸和醋酸都稀释2倍,盐酸中c(H+)变为原来的一半,而醋酸是弱酸,稀释后,电离程度增大,c(H+)比稀释前小,但大于原来浓度的一半,即比盐酸溶液中H+的浓度大,锌与醋酸的反应速率快;酸和锌的量都是已知的,首先进行过量判断,经计算锌的量不足,所以两种溶液放出H2的量是相等的。
本题难度:简单