微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 由FeO、Fe2O3和Fe3O4组成的混合物,测得混合物中铁元素与氧元素的质量比为21∶8,则此混合物中FeO、Fe3O4,Fe2O3的物质的量之比为
A.1∶2∶1
B.2∶1∶1
C.1∶1∶1
D.1∶1∶3
参考答案:AC
本题解析:试题分析:设FeO、Fe2O3和Fe3O4的物质的量分别是x? y z 则,
56(x+2y+3z):16(x+3y+4z)=21∶8
化简28(x+2y+3z):(x+3y+4z)=21∶1
28x+56y+84z=21x+63y+84z
7x=7y,z消掉了,说明只要FeO和Fe2O3是1:1,Fe3O4可以是任意值。故选AC。
考点:物质的量的计算
点评:本题考查利用化学式的计算,明确元素的质量比的计算,在解题过程中注意Fe3O4中铁元素和氧元素的质量比恰好为21:8是关键信息。
本题难度:困难
2、选择题 有一未知浓度的盐酸溶液25?mL,在加入0.5?mol·L-1?AgNO3溶液25?mL后,改加NaOH溶液,结果用去0.1?mol·L-1NaOH溶液25?mL,恰好完全中和,则盐酸的物质的量浓度为
A.0.2 mol·L-1
B.0.5 mol·L-1
C.0.1 mol·L-1
D.0.25 mol·L1
参考答案:C
本题解析:本题是利用元素守恒的原则进行的计算,AgNO3溶液不消耗H+。H+ + OH- == H2O由于盐酸和NaOH体积相同,所以浓度相同。
以后同学们在做这种类型的题时,一定要审准题,不要被题目中所设的陷阱所迷惑。
本题难度:困难
3、选择题 下列分子数一定相同的一组是
A.11.2 L氩气和0.5 mol 氢气
B.2g氢气和16g O2
C.同温同压下,2L H2和2L SO3
D.通常状况下1 mol O2和标准状况下2 g氢气
参考答案:D
本题解析:物质的量相同,分子数一定相同.
本题难度:困难
4、计算题 铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

根据题意回答下列问题:
(1)固体X中主要含有?(填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用?(填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH <5,其目的是?。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
?、过滤、?、干燥。
(4)下表是相关物质的溶解度数据,操作III发生反应的化学方程式是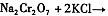
 。该反应在溶液中能发生的理由是:?。
。该反应在溶液中能发生的理由是:?。

(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量?(填写试剂)、溶解、过滤、再加入过量?(填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为?(用含m、n的代数式表示)。
参考答案:(15分)
⑴Fe2O3、MgO(2分);pH计或精密pH试纸(1分)。
⑵使CrO42-转化为Cr2O72-(3分)
⑶冷却结晶,洗涤(各1分)
⑷K2Cr2?O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2?O7的溶解度最小)。(2分)
⑸NaOH溶液、通入过量二氧化碳。(各1分)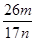 (3分)
(3分)
本题解析:⑴加热焙烧时FeO·Cr2O3、Al2O3、转化成了可溶性的Na2CrO4、NaAlO2,用水浸取后过滤,滤渣为MgO、Fe2O3;测pH是否等于4.5,应用pH计或精密pH试纸
⑵酸化步骤用醋酸调节溶液pH <5,其目的是使CrO42-转化为Cr2O72-。
⑶按操作的过程可看出差的两步是:冷却结晶,洗涤。
⑷K2Cr2?O7的溶解度比Na2Cr2O7小(或四种物质中K2Cr2?O7的溶解度最小)。
⑸依题意应先把氢氧化铝转化为可溶性的偏铝酸钠,过滤除杂质,再将偏铝酸钠转化为氢氧化铝,最后变为氧化铝m g。故先加过量NaOH溶液、再通入过量二氧化碳。氢氧化铝质量分数为(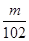 ×78×2) ÷n=
×78×2) ÷n=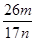
本题难度:困难
5、选择题 下述实验不能达到预期目的的是? ( )。
编号
| 实验内容
| 实验目的
|
A
| 将含有HCl杂质的CO2通入饱和Na2CO3溶液中
| 除去CO2中的HCl
|
B
| 将一定量的KNO3和NaCl的混合液加热并浓缩至有晶体析出,趁热过滤
| 分离出NaCl晶体
|
C
| 在含有少量FeCl3的MgCl2酸性溶液中加入足量MgO并过滤
| 除去溶液中的FeCl3
|
D
| 在含有少量Na2S的NaCl溶液中加入AgCl,再过滤
| 除去溶液中的Na2S
|
?
参考答案:A
本题解析:选项A,Na2CO3也能吸收CO2,应该用饱和NaHCO3溶液吸收其中的HCl。选项B,由于在较高温度下,KNO3和NaCl溶解度相差较大,可采用浓缩、结晶、过滤的方法分离。选项C,MgO和酸反应促进Fe3+水解形成Fe(OH)3,通过过滤即可除去MgCl2溶液中的FeCl3杂质。选项D,Na2S和AgCl反应生成Ag2S沉淀和NaCl,过滤除去Ag2S和剩余的AgCl,即可除去NaCl溶液中的Na2S。
本题难度:一般