微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列四个图像的有关说法正确的是(?)
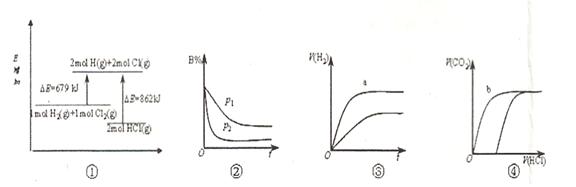
A.①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183kJ/mol
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体
2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体
C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液
D.④表示10mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.lmol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液
参考答案:C
本题解析:A不正确,该反应是放热反应,△H小于0;选项B中,根据图像可知,曲线P2德尔斜率大,所以P2大于P1,这说明压强越大,B的百分含量越小,即正反应是体积减小的反应,所以D一定不是气体,B不正确;醋酸是弱酸,在pH相等的条件下,醋酸的浓度大于盐酸的,反应速率快,C正确;碳酸钠和盐酸反应是分步进行的,所以b表示的是碳酸氢钠,D不正确,答案选C。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像 1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平” 。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
本题难度:一般
2、填空题 (10分)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
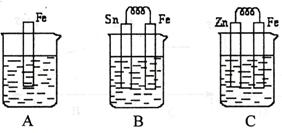
(1)A中反应的离子方程式为?。
(2)B中Sn极的电极反应式为?,Sn极附近溶液的pH(填“增大”、“减小”或“不变”)?。
(3)C中被腐蚀的金属是?,总反应方程式?
参考答案:(1)Fe+2H+=Fe2++H2↑?(2)2H++2e=H2↑?增大
(3)Zn?Zn+2H+=Zn2++H2↑
本题解析:(1)A是原电池,铁直接和稀硫酸发生置换反应生成氢气,离子方程式为Fe+2H+=Fe2++H2↑。
(2)B构成原电池,铁比锡活泼,铁是负极,Sn是正极,溶液中的氢离子在正极得到电子,反应式为2H++2e=H2↑,所以正极附近溶液的酸性会降低,pH会增大。
(3)C也是原电池,但锌比铁活泼,锌是负极,失去电子被腐蚀。铁是正极,溶液中的氢离子在正极得到电子,因此总反应式为Zn+2H+=Zn2++H2↑。
本题难度:一般
3、选择题 在下图中的8个装置中,属于原电池的是( )
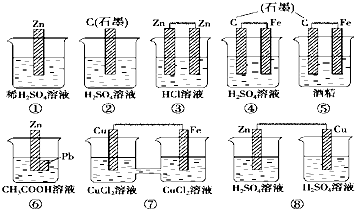
A.①④⑤
B.③⑥⑧
C.④⑥⑦
D.⑥⑦⑧
参考答案:①该装置只有一个电极材料,所以不能形成原电池,故错误.
②该装置只有一个电极材料,且石墨和电解质溶液不能自发的进行氧化还原反应,所以不能形成原电池,故错误.
③两电极材料相同,所以不能形成原电池,故错误.
④该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑤酒精不是电解质,铁和酒精不能自发的进行氧化还原反应,所以不能形成原电池,故错误.
⑥该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑦该装置符合原电池的构成条件,所以能形成原电池,故正确.
⑧该装置两电极间不能构成闭合回路,所以不能形成原电池,故错误.
故选C.
本题解析:
本题难度:简单
4、填空题 将0.23 mol SO2和0.11 mol O2放入容积为1 L的密闭容器中,发生反应2SO2+O2 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K=?。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度??(填“增大”“不变”或“减小”),氧气的转化率??(填“升高”“不变”或“降低”),SO3的体积分数??(填“增大”“不变”或“减小”)。
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K=?。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度??(填“增大”“不变”或“减小”),氧气的转化率??(填“升高”“不变”或“降低”),SO3的体积分数??(填“增大”“不变”或“减小”)。
参考答案:23.8 mol-1·L 减小 降低 减小
本题解析:2SO2+O2 2SO3平衡时,各物质浓度分别为0.11mol/L、0.05mol/L、0.12mol/L,
2SO3平衡时,各物质浓度分别为0.11mol/L、0.05mol/L、0.12mol/L,
依据平衡常数的概念K= 23.8 mol-1·L
23.8 mol-1·L
再加入氧气0.50 mol,平衡右移,平衡后SO2的平衡浓度减小,但氧气本身的转化率减小
由于混合物的总物质的量增加的程度远大于新生成的SO3,故SO3在混合气体中的体积分数反而减小
本题难度:一般
5、填空题 (共8分)依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。
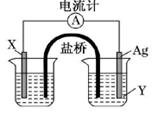
请回答下列问题:
(1)电极X的材料是____:电解质溶液Y的溶质是____:
(2)银电极为电池的____极,发生的电极反应为____;x电极上发生的电极反应为____;
(3)盐桥中装有含琼胶的KNO3饱和溶液,则盐桥中NO3-移向____。(填“左侧烧杯”或“右侧烧杯”)
参考答案:(电极反应式每空2分,其它每空1分,共8分)
(1)Cu AgNO3 (2)正 Ag++e-=Ag Cu-2e-=Cu2+ (3)左侧烧杯
本题解析:(1)在反应2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)中,铜元素的化合价由0价升高到+2价,说明失电子,作原电池的负极,所以电极X的材料是Cu,该装置设有盐桥,所以将铜插入硫酸铜溶液中,将银插入硝酸银溶液中,则电解质溶液Y的溶质是AgNO3;
(2)铜作负极,则银电极是正极,电极反应为Ag++e-=Ag,X电极是负极,电极反应为Cu-2e-=Cu2+,
(3)左侧烧杯的电极是负极,带正电,所以盐桥中NO3-移向左侧烧杯。
考点:考查原电池的工作原理。
本题难度:一般