微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 agNa2CO3和NaHCO3混合物加热至质量减少到bg,则混合物 中NaHCO3的质量分数为:?。
中NaHCO3的质量分数为:?。
参考答案: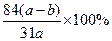
本题解析:解:设NaHCO3的质量为x
2NaHCO3====Na2CO3+H2+CO2↑? △m
168g? 106g? 168g-106g=62g
x?(a-b)g
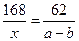 ?解得x=
?解得x=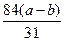 ?
?
得NaHCO3的质量分数为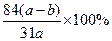
本题难度:简单
2、填空题 (12分)金属钠在氧气中充分燃烧生成产物是?色,将所得产物投入水中,产物和水迅速发生反应,写出该反应的化学方程式:?。向上所得溶液中加入FeSO4溶液,看到的现象:?,此过程中发生的氧化还原反应的化学方程式:?。
参考答案:(1)淡黄色?2Na2O2 + 2H2O ="=" 4NaOH+ O2 ↑?
(2)生成白色沉淀,迅速变灰绿色,最后变红褐色。
4Fe(OH)2 + O2 +2H2O ="=" 4Fe(OH)3
本题解析:略
本题难度:简单
3、选择题 将金属元素钠在空气中燃烧,生成Na2O与Na2O2的混合物。取该燃烧产物7.48g溶于水制成1000mL溶液,取出10mL用0.1mol/L的盐酸中和,用去盐酸20mL,由此可知该产物中Na2O的质量分数约为 [ ]
A.16.6%
B.20%
C.80%
D.78.4%
参考答案:A
本题解析:由盐酸和NaOH反应的化学方程式知:Na2O与Na2O2混合
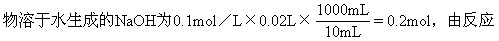
Na2O+H2O==2NaOH
1mol 2mol
2Na2O2+2H2O==4NaOH+O2↑
1mol 2mol
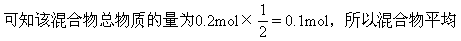
分子量为74.8,由十字交叉法:
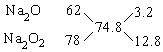
所以,nNa2O∶nNa2O2=3.2∶12.8=1∶4,即Na2O物质的量分数为20%,由Na2O和Na2O2的分子相对质量知Na2O的质量分数一定小于20%
本题难度:简单
4、填空题 Na与S反应可以生成多种产物:Na2S,Na2S2……Na2S5。已知Na2S2的电子式为 则S32-的电子式为?。已知Na2S3+2HCl = 2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:?。工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3。试写出电解熔融NaOH的反应方程式:?,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为?。
则S32-的电子式为?。已知Na2S3+2HCl = 2NaCl+H2S↑+2S↓,试写出Na2S5与醋酸反应的离子方程式:?。工业上常用电解熔融NaCl制Na,事实上电解许多熔融的钠的化合物也能制备Na,如NaOH、Na2CO3。试写出电解熔融NaOH的反应方程式:?,若电解熔融Na2CO3时有CO2气体产生,则阳极电极反应式为?。
参考答案: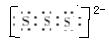 (2分)
(2分)
S52-+2CH3COOH==2CH3COO—+H2S+4S?(2分)
4NaOH==4Na+O2+2H2O?(2分)
2CO32—?—4e—==2CO2+O2?(2)
本题解析:略
本题难度:一般
5、推断题 物质的转化关系如图所示(有的反应可能在水溶液中进行,有的反应中反应物和生成物未全部给出,反应条件也未注明),其中甲可 由 两种单质直接化合得到,乙为金属单质,F的溶液中只含一种溶质,G 为酸,乙在G的浓溶液中发生钝化。
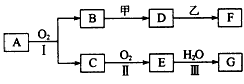
(1)若甲是既有离子键又含有非极性共价键的淡黄色固体化合物,化合物A所含的电子数与Ne原子相同。
①1.7g A与O2反应生成气态的B和C时放出22.67kJ热量,写出该反应的热化学方程式。
_____________________
②写出B与甲反应的化学方程式。_____________________
③写出D与乙反应的离子方程式。_____________________
(2)若乙的基态原子外围电子排布式为3d64s2,A为含有乙元素的化合物,框图中的甲改为甲的溶液。
①写出D溶液中金属离子基态时外围电子排布式_____________________
②说明C转化为E的反应条件_____________________
参考答案:
(1)①4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H= -906.8kJ/mol;②2Na2O2+2H2O=4NaOH+O2↑;③2Al+2H2O+2OH-=2AlO2-+3H2↑
(2)①3d5;②常压、加热、催化剂
本题解析:
本题难度:一般