微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一密闭容器中加入xmol的Na2O2和ymol的NaHCO3固体充分加热,下列有关加热后容器中残留固体成分和导出气体成分的说法正确的是
A.若x=y,气体中只含有0.5x molO2,固体中含有2y molNa2CO3和y molNaOH
B.若0.5y<x<y,气体中含有0.5y molH2O,固体中含有y molNaOH和y molNa2CO3
C.若0.5y=x,气体中有0.5x molO2,固体中有y molNaOH和y molNa2CO3
D.若x<0.5y,气体中含有(0.5y—x)molCO2,固体中含有(x+0.5y)molNa2CO3
参考答案:D
本题解析:根据NaHCO3固体充分加热,受热分解生成二氧化碳和水。二氧化碳和水又和过氧化钠反应生成碳酸钠和氧气。当x<0.5y,气体中二氧化碳过量,最终含有(0.5y—x)molCO2,固体中含有(x+0.5y)molNa2CO3
本题难度:简单
2、计算题 (8分)加热10.0克碳酸钠和碳酸氢钠混合物质质量不再变化,剩余固体的质量为8.45克,求混合物中碳酸钠的质量分数。
参考答案:58%
本题解析:可依据差量法计算
2NaHCO3=Na2CO3+H2O+CO2↑?△m
2×84g? 18? 44? 62
m? 10.0—8.45
m=4.2g
故碳酸钠的质量分数为: =58%
=58%
本题难度:一般
3、简答题 某同学设计了如图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请根据下列实验回答问题:
(1)若A为水,B为过氧化钠,C中盛有酸化过的FeCl2溶液,旋开活塞E后,C中的现象为______,
C中发生反应的离子方程式为______;
(2)利用上述装置还可以验证物质的性质,如设计证明氧化性:KMnO4>Cl2,并制取漂白液,则A中加浓盐酸,B中加______溶液,C中发生反应的离子方程式为______.
(3)利用上述装置还可以验证SO2的化学性质,A为硫酸,B为亚硫酸钠固体,那么C中盛有______溶液时可验证其还原性;?而C中盛有______溶液时可验证其漂白性.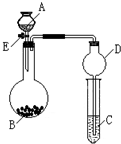
参考答案:(1)过氧化钠与水反应生成氧气,能氧化具有还原性的FeCl2,生成黄色的Fe3+,发生反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:溶液由浅绿色逐渐变为(棕)黄色,4Fe2++O2+4H+=4Fe3++2H2O;
(2)KMnO4>Cl2,酸性高锰酸钾与浓盐酸反应生成氯气,B中应加入高锰酸钾,制备漂白液,用氯气和NaOH溶液反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:高锰酸钾(酸性高锰酸钾);Cl2+2OH-=Cl-+ClO-+H2O;
(3)SO2具有还原性,可与氯水等氧化性物质反应,SO2具有漂白性,可使品红褪色,所以C中应盛有品红,
故答案为:氯水(或溴水或酸性高锰酸钾溶液);品红.
本题解析:
本题难度:一般
4、选择题 下列物质间的转化在给定条件下能一步实现的是
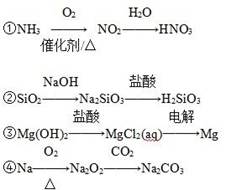
A.②④
B.③④
C.①④
D.①②③
参考答案:A
本题解析:本题考查了给定条件下物质之间的转化,意在考查考生对元素化合物知识的理解与应用能力。氨的催化氧化为4NH3+5O2 4NO+6H2O,一步只能生成NO,①错;SiO2+2NaOH===Na2SiO3+H2O, Na2SiO3+2HCl===H2SiO3↓+2NaCl,②正确;电解MgCl2溶液不能得到金属镁,电解熔融的MgCl2才能得到金属镁,③错;2Na+O2
4NO+6H2O,一步只能生成NO,①错;SiO2+2NaOH===Na2SiO3+H2O, Na2SiO3+2HCl===H2SiO3↓+2NaCl,②正确;电解MgCl2溶液不能得到金属镁,电解熔融的MgCl2才能得到金属镁,③错;2Na+O2 Na2O2,2Na2O2+2CO2===2Na2CO3+O2,④正确。
Na2O2,2Na2O2+2CO2===2Na2CO3+O2,④正确。
本题难度:一般
5、选择题 向氢氧化钠溶液中滴加几滴下列溶液,一定能得到白色沉淀的是
A? Al2(SO4)3溶液? B? CaCl2 溶液? C FeCl2溶液? D? MgSO4溶液
参考答案:D
本题解析:A不能,铝离子与氢氧化钠反应生成氢氧化铝沉淀,但氢氧化铝沉淀要溶解于过量的强碱溶液中。
B不能,钙离子与氢氧根离子不反应。
C不能,亚铁离子与氢氧根离子反应生成氢氧化亚铁,接着迅速被氧化再生成氢氧化铁,是红褐色沉淀。
D可以,镁离子与氢氧根离子反应生成白色沉淀氢氧化镁,不溶于碱。
本题难度:一般