微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是?
[? ]
A.在水溶液中导电能力弱的电解质一定是弱电解质
B.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强
C.易溶于水的电解质不一定是强电解质
D.强电解质在水溶液中的电离过程是不可逆的
参考答案:CD
本题解析:
本题难度:简单
2、选择题 在CH3COONa溶液中各离子的浓度的关系不正确的是( )
A.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B.c(Na+)=c(CH3COO-)+c(CH3COOH)
C.c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
参考答案:A.由溶液的电离守恒可知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.由物料守恒可知c(Na+)=c(CH3COO-)+c(CH3COOH),故B正确;
C.CH3COONa为强碱弱酸盐,因CH3COO-发生水解生成CH3COOH,则有c(Na+)>c(CH3COO-),故C错误;
D.CH3COONa为强碱弱酸盐,水解呈碱性,因CH3COO-发生水解生成CH3COOH,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确.
故选:C.
本题解析:
本题难度:简单
3、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.1.0mol/L?Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
B.1.0mol/L?NH4Cl溶液:c(NH4+)=c(Cl-)
C.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
参考答案:AD
本题解析:
本题难度:简单
4、选择题 pH=3的H2SO4溶液和pH=10的NaOH溶液混合,要使混合液的pH=7,则硫酸和氢氧化钠溶液的体积比应为
A.1:10
B.1:9
C.1:20
D.1:2
参考答案:A
本题解析:试题分析:根据强酸与强碱混合,恰好呈中性,则氢离子与氢氧根离子物质的量相等,
 ,求出:
,求出: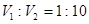 。
。
考点:考查酸碱混合的计算。
点评:酸碱混合首先考虑混合后呈酸性、碱性、中性。
本题难度:一般
5、填空题 七种物质回答问题:①?氢氧化钠固体 ②?铜丝 ③?氯化氢气体 ④?稀硫酸溶液 ⑤?二氧化碳气体 ⑥?蔗糖晶体 ⑦ 熔融氯化钠
属于电解质的是:?(填编号,下同),属于非电解质的是?,能导电的是?。
参考答案:①③⑦;?⑤⑥;?②④⑦
本题解析:物质能否导电是根据物质是否有电子或自由移动的离子判断:金属有电子,电解质的水溶液或熔融下的电解质有自由移动的离子,能导电的为:②④⑦;电解质非电解质研究的对象为化合物,:必须是化合物,电解质在水溶液里或熔融状态下电离出自由移动的离子,且离子是物质本身电离的,不能是与其它物质反应后的物质电离的。②铜丝是单质,④稀硫酸?是混合物所以既不是电解质也不是非电解质;⑤二氧化碳气体溶于水能导电,但电离出离子的是碳酸不是二氧化碳,所以二氧化碳是非电解质;⑥蔗糖晶体在水溶液里或熔融状态下不能电离出自由移动的离子所以是非电解质。故电解质为:①③⑦非电解质为:⑤⑥。
本题难度:一般