微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 回答下列问题:
Ⅰ、有下列物质:①Fe ②CO2 ③Na2O ④Cu(OH)2 ⑤MgCl2 ⑥NH4Cl ⑦H2SO4
⑧C2H5OH(酒精)(用序号作答).
上述十种物质中,其中属于电解质的有______,属于非电解质的有______.
Ⅱ、今有K2SO4和Al2(SO4)3的混合溶液,已知其中K+浓度是0.2mol?L-1,SO42-的浓度是0.7mol?L-1.
(1)写出Al2(SO4)3电离的电离方程式:______.
(2)Al3+浓度应等于______mol/L
Ⅲ、根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
(1)该反应中氧化剂是______,被氧化的是______元素.
(2)该反应中参加氧化还原的氧化剂与还原剂的物质的量之比为______.
(3)用双线桥法标出电子转移的方向与数目______.
参考答案:I.①Fe是单质,既不是电解质也不是非电解质;②CO2 本身不能电离,属于非电解质;③Na2O是化合物且熔融状态下导电,属于电解质;④Cu(OH)2是化合物且熔融状态下导电,属于电解质;⑤MgCl2是化合物,在水溶液或者熔融状态都导电,属于电解质;⑥NH4Cl是化合物溶液中导电,属于电解质; ⑦H2SO4 是化合物溶液中导电,属于电解质;⑧C2H5OH(酒精)是化合物,在水溶液和融化状态下都不导电,是非电解质,故答案为:③④⑤⑥⑦;②⑧;
II.(1)硫酸铝是强电解质完全电离,电离方程式:Al2(SO4)3=2Al3++3SO42-;
故答案为:Al2(SO4)3=2Al3++3SO42-;
(2)溶液呈中性,根据电荷守恒列关系式:C(Al3+)×3+C(K+)=2×C(SO42-),将各种离子浓度带入得:C(Al3+)×3+0.2mol?L-1=2×0.7mol?L-1.
C(Al3+)=0.4mol/L;
故答案为:0.4mol/L;
III (1)该反应氨气中的氯气中的氯元素化合价降低,所以氯气是氧化剂;氮元素化合价升高,被氧化;
故答案为:Cl2或氯气;N或氮;
(2)在反应8NH3+3Cl2=6NH4Cl+N2,3mol氯气中的氯元素化合价都降低,所以3mol氯气都做氧化剂;8mol氨气中只有2mol氨气中的氮元素化合价升高,所以做还原剂的氨气只有2mol,所以氧化剂和还原剂物质的量之比是3:2;
故答案为:3:2;
(3)根据得失电子守恒的原理用双线桥法标出电子转移的方向与数目.
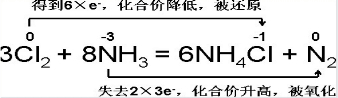 ;
;
故答案为: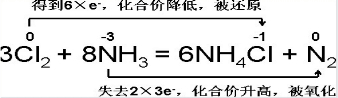 .
.
本题解析:
本题难度:一般
2、选择题 下列属于强电解质的是( )①NaOH?②NH3?H2O?③KCl?④醋酸?⑤NaHCO3.
A.①②⑤
B.①③④
C.②③④
D.①③⑤
参考答案:①NaOH在水溶液里或熔融状态能完全电离出阴阳离子,所以是强电解质,故正确;
②NH3?H2O在水溶液里只有部分电离出阴阳离子,所以是弱电解质,故错误;
③KCl在水溶液里或熔融状态能完全电离出阴阳离子,所以是强电解质,故正确;
④醋酸在水溶液里只有部分电离出阴阳离子,所以是弱电解质,故错误;
⑤NaHCO3在水溶液里或熔融状态能完全电离出阴阳离子,所以是强电解质,故正确.
故选D.
本题解析:
本题难度:一般
3、选择题 下列各组物质中,前者为强电解质,后者为弱电解质的是(?)
A.硫酸,硫酸钡
B.碳酸,碳酸钠
C.食盐,酒精
D.碳酸氢钠,醋酸
参考答案:D
本题解析:
正确答案:D
强电解质是指在水溶液里全部电离成离子的电解质。强酸、强碱和大部分盐类都是强电解质。
A、强电解质,强电解质;B弱电解质、强电解质;C、强电解质,非电解质;D、强电解质,后者为弱电解质。
本题难度:简单
4、填空题 直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2.
(1)用化学方程式表示S形成硫酸酸雨的反应方程式______,______.
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是______.
(3)吸收液吸收SO2的过程中,pH随n(SO32-),n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91
pH
8.2
7.2
6.2
|
①上表判断NaHSO3溶液显______性,用化学平衡原理解释:______.
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):______.
a、c(Na+)=2c(SO32-)+c(HSO3-)
b、c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-)
c、c(Na+)+c(H-)=c(SO32-)+c(HSO3-)+c(OH-)
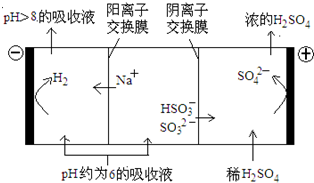
(4)当吸收液的pH降至约为6时,送至电解槽再生.再生示意图如图:
①HSO3-在阳极放电的电极反应式是______.
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理:______.
参考答案:(1)二氧化硫是酸性氧化物,和水反应生成亚硫酸,反应方程式为:SO2+H2O?H2SO3;亚硫酸不稳定能被空气中的氧气氧化生成硫酸,反应方程式为2H2SO3+O2=2H2SO4.
故答案为:SO2+H2O?H2SO3;2H2SO3+O2=2H2SO4.
(2)酸性氧化物和碱反应生成盐和水,所以二氧化硫和氢氧化钠反应生成亚硫酸钠和水,
反应方程式为2OH-+SO2=SO32-+H2O.
故答案为:2OH-+SO2=SO32-+H2O.
(3)①在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性,亚硫酸氢根离子既能水解又能电离,亚硫酸氢钠溶液呈酸性同时说明HSO3-的电离程度大于水解程度.
故答案为:酸性;HSO3-存在HSO3-?H++SO32- 和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
②当溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度.
a、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,所以c(Na+)=2c(SO32-)+c(HSO3-),故正确.
b、溶液呈中性时,溶液中氢离子浓度等于氢氧根离子浓度,亚硫酸氢根离子浓度大于亚硫酸根离子浓度,溶液中阴阳离子所带电荷相等,所以得c(Na+)>c(HSO3-)>c(SO32-)>c(H-)=c(OH-),故正确.
c、溶液呈电中性,溶液中阴阳离子所带电荷相等,得c(Na+)+c(H-)=2c(SO32-)+c(HSO3-)+c(OH-),故错误.
故选ab.
(4)①当吸收液的pH降至约为6时,吸收液中阴离子主要是亚硫酸氢根离子,亚硫酸氢根离子在阳极上失电子和水反应生成硫酸根离子和氢离子,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+.
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
②电解时,溶液中阳离子向阴极移动,氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,导致加速HSO3-电离生成SO32-,钠离子进入阴极室,吸收液就可以再生.
故答案为:氢离子在阴极得电子生成氢气,溶液中氢离子浓度降低,促使HSO3-电离生成SO32-,且钠离子进入阴极室,吸收液就可以再生.
本题解析:
本题难度:简单
5、选择题 下列物质都能导电,其中属于电解质的是( )
A.稀盐酸
B.熔融的NaCl
C.铜丝
D.NaOH溶液
参考答案:A.盐酸有自由移动的氯离子和氢离子,能导电,盐酸是氯化氢的水溶液,是混合物,既不是电解质,也不是非电解质,故A错误;
B.熔融的氯化钠,是化合物,属于电解质,电离出钠离子和氯离子,能导电,故B正确;
C.铜丝是金属单质,能导电,但它既不是电解质也不是非电解质,故C错误;
D.NaOH溶液中有自由移动的钠离子和氢氧根离子,能导电,但它是混合物,电解质必须是化合物,所以,它既不是电解质也不是非电解质,故D错误;
故选B.
本题解析:
本题难度:一般