微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用图中装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是
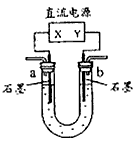
[? ]
电源X极?
实验前U形管中液体
通电后现象或结论
A.
正极?
Na2SO4溶液
U形管两端滴入酚酞后,a管中呈红色
B.
正极
AgNO3溶液
b管中电极反应式是
C.
负极
CuCl2溶液
?一段时间后,a管中石墨电极有红色物质析出
D.
负极
胶体和导电液
?b管中液体颜色加深
参考答案:C
本题解析:
本题难度:一般
2、填空题 工业上电解饱和食盐水能制取多种化工原料,其中部分原料可用于制备多晶硅。
(1) 右图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是?;NaOH溶液的出口为______(填字母);精制饱和食盐水的进口为_____(填字母);干燥塔中使用的液体干燥剂是____(每空2分)。

(2) 原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加人的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是?(2分)(填序号)。
(3) 多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为??(2分)。 也可转化为
也可转化为 而循环使用。一定条件下,在200C恒容密闭容器中发生反应:
而循环使用。一定条件下,在200C恒容密闭容器中发生反应: ,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
,达平衡后,H2与SiHCL3物质的量浓度分别为0. 140mol/L和0. 020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的物质的量为_______ (2分)mol。
(4)已知1 g阴极产生的气体在阳极产生的气体中完全燃烧时放出92. 3 kj的热量,则该反应的热化学方程式为: ???(2分)。
参考答案:(1)氯气(Cl2);___a___ (填字母);__d___ (填字母);__浓硫酸__(每空2分)。
(2)③①②(2分)。
(3)  (2分)。___6____ (2分)mol。
(2分)。___6____ (2分)mol。
(4) ?(2分)。
?(2分)。
本题解析:略
本题难度:一般
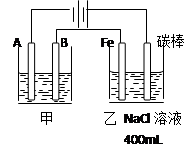
3、填空题 如图所示的装置中,甲为铜锌原电池,A、B均为石墨电极,请回答下列问题:
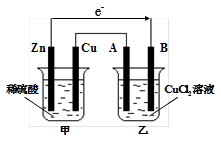
(1)Zn电极为 极,B电极上的产物是 (写化学式)
(2)写出乙装置中发生反应的化学方程式
参考答案:(1)负 Cu (2)CuCl2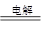 Cu+Cl2↑
Cu+Cl2↑
本题解析:(1)锌比铜活泼,且锌能和稀硫酸反应,所以甲装置是原电池,乙装置是电解池。其中锌是负极,B电极是阴极,溶液中的铜离子在阴极放电,生成单质铜。
(2)惰性电极电解氯化铜溶液的方程式是CuCl2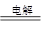 Cu+Cl2↑。
Cu+Cl2↑。
考点:考查原电池、电解池的有关判断
点评:该题是高考中的常见题型,属于基础性试题的考查。试题紧扣教材,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是明确原电池和电解池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
4、填空题 (20分)如图为相互串联的甲乙两个电解池,请回答:
(1)若甲池为电解精炼粗铜(含有锌铁镍银金和铂等微量杂质,杂质发生的电极反应不必写出)装置,电解液选用CuSO4溶液,则:
①A电极发生的反应类型为?; B电极和Fe电极电子的流向由?到?(填B或Fe)。
②B电极的材料是____________,电极反应式为___________? _______。
CuSO4溶液的浓度?(填 “不变”“略有增加”或“略有减少”)
(2)实验开始时,若在乙池两边电极附近同时各滴入几滴酚酞试液,则:
①写出电解NaCl溶液总的化学方程式?
?。
②在Fe极附近观察到的现象是____? ________。检验碳棒电极反应产物的方法是 ?_。
(3)若甲槽电解液为CuSO4,实验中发现阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_____? ____L。若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为_______? ___?。
参考答案:(1) ①?还原反应? B到Fe(共2分)
②粗铜? Cu - 2e - = Cu2+?略有减少
(2) ①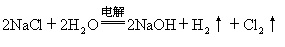 ,②溶液变红。把湿润的碘化钾淀粉试纸放在碳棒附近,试纸变蓝色。(3)4.48L? (4)1mol·L-1
,②溶液变红。把湿润的碘化钾淀粉试纸放在碳棒附近,试纸变蓝色。(3)4.48L? (4)1mol·L-1
本题解析:(1)根据装置图可看出,A是阴极、B是阳极、铁是阴极、碳棒是阳极。所以A电极发生还原反应,B发生氧化反应,电子由B电极通过导线传递到铁电极上。粗铜精炼时阳极必须连粗铜,电极反应式为Cu - 2e - = Cu2+。由于粗铜中含有比铜活泼的金属,当这些活泼的金属失电子时,在阴极上溶液的铜离子放电,所以CuSO4溶液的浓度略有减少。
(2)乙池是电解NaCl溶液的,阳极是碳棒,溶液中的氯离子放电,生成氯气,检验氯气可利用其氧化性通过湿润的碘化钾淀粉试纸来检验。铁是阴极,溶液中由水电离出来的氢离子生成氢气,所以在阴极周围溶液显碱性。
(3)阴极增重12.8g,说明析出铜是0.2mol,转移电子0.4mol。根据得失电子守恒可知乙槽阴极放出氢气是0.2mol,在标准状况下的体积为4.48L。根据电解的总方程式可知生成氢氧化钠是0.4mol,电解后得到碱液的物质的量浓度为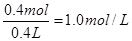
。
本题难度:一般
5、选择题 如图所示,电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。下表中说法正确的是

?
| 电极材料
| 通电后的变化
|
阴极
| 阳极
|
A
| 石墨
| 石墨
| 阴极质量增加,溶液的pH增大
|
B
| 铜
| 铜
| 阳极质量减小,阴极质量增加
|
C
| 铁
| 铁
| 两极的质量不发生变化
|
D
| 铂
| 铁
| 阴极质量增加,溶液的浓度不变
参考答案:B
本题解析:若用石墨作为电极电解硫酸铜溶液,则阳极OH-放电产生氧气,溶液的碱性减弱,pH降低;阴极Cu2+放电析出铜,A不正确。若用铜电极电解硫酸铜溶液,类似于粗铜的提纯,选项B正确。若用铁电极电解硫酸铜溶液,阴极Cu2+放电析出铜,阳极铁失去电子而溶解,C不正确。若用铂作阴极,铁作阳极电解硫酸铜溶液,仍然是阴极Cu2+放电析出铜,阳极铁失去电子而溶解,但溶液中Cu2+浓度减小,Fe2+增大,D也不正确。
本题难度:一般
|