微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
A.离子半径:X+ >Y-
B.Z元素的最高正化合价与最低负化合价代数和为4
C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物
D.Y的氢化物中存在离子键
参考答案:C
本题解析:由题推断知,X是K,Y是Cl,Z是O。离子半径大小顺序是,X+小于Y-;氧
没有最高正化合价;Y的氢化物是HCl,只有共价键。答案选C。
本题难度:一般
2、填空题 (14分)下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白: 
?主族
 周期 周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0族
|
2
| ?
| ?
| ?
| ①
| ②
| ③
| ?
| ?
|
3
| ④
| ?
| ⑤
| ?
| ?
| ⑥
| ⑦
| ⑧
|
 (1) 在这些元素中,化学性质最不活泼的是:? _?(填具体元素符号,下同)。
(1) 在这些元素中,化学性质最不活泼的是:? _?(填具体元素符号,下同)。
 (2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的分子式是_____________。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是____________,碱性最强的化合物的分子式是_____________。
 (3) 最高价氧化物的水化物显两性的是?;写出它与盐酸反应的离子方程式?。
(3) 最高价氧化物的水化物显两性的是?;写出它与盐酸反应的离子方程式?。
 (4) 表示元素④与⑦形成的化合物的电子式?。
(4) 表示元素④与⑦形成的化合物的电子式?。
 (5)表示元素①与③形成的化合物的电子式?。
(5)表示元素①与③形成的化合物的电子式?。
参考答案:(每空2分共14分)
 (1)Ar?
(1)Ar? (2)HClO4? NaOH?
(2)HClO4? NaOH? (3)Al(OH)3? Al(OH)3+3H+=Al3++3H2O
(3)Al(OH)3? Al(OH)3+3H+=Al3++3H2O ? (4)NaCl 电子式
? (4)NaCl 电子式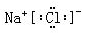 ? (5)CO2 电子式
? (5)CO2 电子式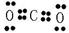
本题解析:(1)稀有气体的最外层电子数已知达到稳定结构,所以化学性质最不活泼。即是Ar。
(2)非金属性越强,最高价氧化物食物水化物的酸性越强,所以是HClO4;金属性越强,最高价氧化物食物水化物的碱性越强,所以是NaOH。
(3)氢氧化铝是两性氢氧化物,和盐酸反应的方程式为Al(OH)3+3H+=Al3++3H2O。
(4)④与⑦分别是钠和氯,生成的是离子化合物氯化钠,电子式为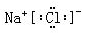 。
。
(5)①与③分别是C和O,形成的是共价化合物CO2,电子式为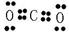 。
。
本题难度:一般
3、选择题 下列叙述不正确的是?(?)
A.Na、Mg、Al的第一电离能依次减弱
B.H2S、H2O、HF的稳定性依次增强
C.NaOH、Mg(OH)2、Al(OH)3的碱性依次减弱
D.H4SiO4、H2CO3、H2SO4酸性依次增强
参考答案:A
本题解析:镁的3s轨道电子处于全充满状态,稳定性其余,所以镁的第一电离能大于Al的,A不正确;非金属性越强,氢化物的稳定性越强,B正确;金属性或非金属性越强,最高价氧化物的水化物碱性或酸性越强,所以选项CD正确,答案选A。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,主要是考查学生灵活运用元素周期律知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力,提高学生的学科素养。
本题难度:一般
4、选择题 Cs是稳定的核电荷数最大的碱金属元素,下列关于铯及其化合物的叙述,正确的是( )
A.铯与冷水反应十分平缓并生成H2
B.铯与硫酸反应,生成CsSO4与H2
C.铯的氧化物可直接与水反应生成CsOH
D.铯在空气中燃烧生成Cs2O
参考答案:C
本题解析:根据钠的性质以及元素周期律可知铯是比钠金属性更强的金属,因此与水反应非常剧烈,铯是一价金属,硫酸铯因为Cs2SO4,铯与氧气反应生成比过氧化物更复杂的氧化物。答案选C。
点评:同主族元素,从上到下,随着原子半径的增大,对电子的束缚能力减弱,金属性增强,非金属性减弱。
本题难度:一般
5、简答题 前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,平且A—和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
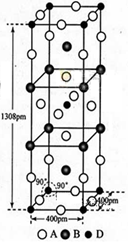
①该化合物的化学式为_________________;D的配位数为___________;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_________;该化合物中存在一个复杂离子,该离子的化学式为________,配位体是?。
参考答案:(1)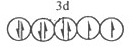
(2)K? F
(3)①K2NiF4;? 6
②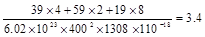
(4)离子键、配位键;[FeF6]3-;F-
本题解析:前四周期原子序数依次增大的元素A、B、C、D中,A和B的价电子层中未成对电子均只有一个,并且A-和B+的电子数相差为8,A属于第VIIA族元素,B属于第IA族元素,且A的原子序数小于B,则A是F元素,B是K元素;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2,且C和D的原子序数大于B,C的原子序数小于D,则C是Fe元素,D是Ni元素
(1)D2+的价层电子为3d电子,根据能量最低原理、保里不相容原理及洪特规则知,其价电子排布图为 ;
;
(2)元素的金属性越强其第一电离能越小,元素的非金属性越强,其电负性越大,这四种元素中金属性最强的是K元素,非金属性最强的元素是F,所以第一电离能最小的是K,电负性最大的是F,
(3)①该晶胞中A原子个数=16×
B原子个数=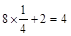
D原子个数=
所以该化合物的化学式为K2NiF4,根据晶胞结构知,D的配位数是6
②该晶胞的体积=(400×10-10cm)(1308×10-10cm)
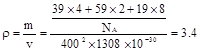 g?cm-3,
g?cm-3,
(4)A-、B+和C3+三种离子组成的化合物的K3FeF6,该物质中阴阳离子间存在离子键,铁原子和氟原子间存在配位键,该化合物中存在一个复杂离子,该离子的化学式为[FeF6]3-,配位体是F-
本题难度:一般