微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 日本福岛第一核电站发生严重的核辐射泄漏,日本政府向福岛核电站附近居民发放碘片(12753I),以降低放射性碘对人体的伤害。已知核辐射中放射性碘(碘13153I)的核电荷数为53,则下列说法正确的是?
A.核裂变是一种化学变化
B.12753I的质量数为127,原子序数为53,核内有74个中子
C.碘12753I和放射性碘13153I属于同素异形体
D.12753I与13153I是同一种核素
参考答案:B
本题解析:
核裂变既不是化学变化,又不是物理变化,是特殊的一种变化,故A错;质子数加中子数等于质量数,B正确;碘12753I和放射性碘13153I属于同位素,由同一种元素形成的不同单质之间互称为同素异形体,C错;一中原子是一中核素,D错。
本题难度:一般
2、填空题 某元素最高价氧化物的水化物的化学式为 HxROy , 且为强酸。气态氢化物的化学式为HxR , 已知 1 mol的HxROy比 1 mol 的HxR 质量多 64 g , 又知道1 mol的HxROy的原子核外电子总数为50mol. 求R的原子序数为?或?。
参考答案:17或16
本题解析:略
本题难度:简单
3、选择题 下列对一些实验事实的理论解释正确的是?
选项
| 实?验?事?实
| 理?论?解?释
|
A
| NH3溶于水形成的溶液微弱导电
| NH3是弱电解质
|
B
| 氮气与氧气反应条件苛刻
| 氮元素的非金属性不强
|
C
| 乙醇与水任意比互溶
| 氢键的影响
|
D
| HF的沸点高于HCl
| H—F的键能比H—Cl的键能强
参考答案:C
本题解析:NH3溶于水形成的溶液微弱导电,是因为生成的一水合氨部分电离,不是氨气本身能电离导电,氨气不是弱电解质,A错;氮气与氧气反应条件苛刻,是因为氮气化学性质稳定,不是可燃气体,与氮元素的非金属性无关,B错;氢键的形成能加大乙醇在水中的溶解度,C正确;HF的沸点高于HCl,是因为HF中氢键的影响,D错误。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验、化学仪器的相关知识的积累。
本题难度:一般
4、填空题 甲、乙、丙是由短周期元素形成的常见单质,丙在常温下为无色气体,且乙、丙两元素同主族,其余均为常见化合物,它们在一定条件下有如下转化关系(反应中生成的水已略去)。
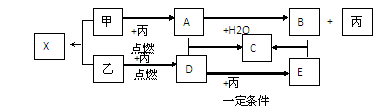
⑴C的化学式是?;B中所含化学键的类型?。
⑵A+D→C的反应属于下列何种反应类型(填字母)?。
A.化合反应
B.氧化还原反应
C.非氧化还原反应
D.离子反应
|
⑶写出甲与H2O反应的化学方程式:?。
⑷请用右图装置证明A和H2O反应是放热反应并有丙生成。
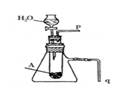
简述合理的实验操作方法:
①?。
②?。
参考答案:(1)? Na2SO4 ?;?离子键和共价键?。
(2)? AB?。
(3)? 2Na + 2H2O =" 2NaOH" + H2?。
(4)①?将q插入水中,反应后q处冒气泡,证明反应放热?。
②?在p处收集气体,该气体能使带有余烬的木条复燃,证明是氧气?。
(其他合理答案均给分)
本题解析:(1)高中阶段所学习的常温下的无色单质气体,而且还是短周期元素构成,那么物质丙的范围可缩小氢气,氧气,氮气三种,再整体观察,甲,乙两种单质均可以在丙中燃烧,并且乙变成D,D再变成E的过程中,丙都参与其中反应,这表明丙有很大可能是氧气。推测丙为氧气,那么乙和丙同主族又是常见单质,所以乙应该是硫单质,D可能为二氧化硫,E为三氧化硫。这样一来由乙到E的这条关系线就比较清晰了。再来推甲到丙的这条线,单质甲在丙中燃烧,生成的产物A可以与水反应放出丙,这一点可以看出单质甲是Na,A为Na2O2,与水反应生成的B就是NaOH,同时也断定丙肯定为氧气。剩余的物质C应该是 Na2SO4,X为Na2S。B中的化学键包括钠离子与氢氧根离子间的离子键,以及氢氧根中氢氧原子间的共价键。
(2)A与D的反应:Na2O2+SO2=Na2SO4属于化合反应,其中化合价发生变化,所以也属于氧化还原反应。
(3)2Na + 2H2O =" 2NaOH" + H2↑
(4)Na2O2与水反应,可以利用受热膨胀的常识进行验证,将q插入水中,反应后q处冒气泡,证明反应放热。至于氧气的验证,可以利用氧气使带火星木条复燃来验证。
本题难度:一般
5、选择题 1907年2月2日,享誉世界的俄国化学家门捷列夫因心肌梗塞与世长辞,那一天距离他的73岁生日只有六天。门捷列夫在科学界的主要贡献是
A.发现色盲现象
B.发现元素周期律
C.发明硝酸甘油炸药
D.发现了放射性元素钋
参考答案:B
本题解析:门捷列夫在科学界的主要贡献是发现元素周期律,并绘制出第一张元素周期表,答案选B。
点评:该题是常识性知识的考查,难度不大,属于识记性的,记住即可。有利于培养学生的学习兴趣,激发学生学习化学的积极性和动力。
本题难度:简单