微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (15分)
我国规定:室内甲醛含量不得超过0.0 8mg·m-3。某研究性学习小组欲利用酸性KMnO4溶液测定空气中甲醛(HCHO)的含量。
【查阅资料】KMnO4 ( H+)溶液为强氧化剂,可氧化甲醛和草酸。
4MnO4―+5HCHO+H+=4Mn2++5CO2↑+11H2O
2MnO4―+5H2C2O4+6H+=2Mn2++10CO2 ↑+8H2O
【实验一】
按如图所示装置进行采样

(1)由图可知甲醛的物理性质为?
(2)空气中甲醛采样吸收装置中用到的玻璃仪器为:玻璃导管、?
(3)为了使通过吸收装置的甲醛尽可能被吸收液吸收,可采取的措施是:(只写出一种即可)?。
设置空气采集器为恒定流量0.5 L/min,采集20min。
【实验二】
量取10.00 mL 的甲醛吸收液转移到锥形瓶中,量取12.00 mL 1.00×10-3 mol·L-1 KMnO4溶液于锥形瓶中,并滴入几滴稀H2SO4备用。
(4)用1.00×10-3 mol·L-1标准草酸溶液进行滴定,当?
时,达到滴定终点。
(5)记录滴定所消耗的草酸溶液的体积。重复实验2次,消耗草酸溶液的体积分别为10.90 mL、10.02 mL、9.98 mL。计算该居室内空气中甲醛的浓度为??mg·m-3。
(6)若滴定过程中,发现滴定管下端开始有气泡,滴定后气泡消失,则测定结果将?
(填“偏大”、“无影响”、“偏小”)
【实验三】
环境监测站工作人员采样后,将5.00 mL 的甲醛吸收液注入比色瓶中,再向比色瓶中注入显色试剂0.5 mL,盖紧瓶塞,摇匀,静置显色。当室内环境温度不同时,记录显色时间见下表。
环境温度/℃
| 5
| 10
| 15
| 20
| 25
| 30
| 35
|
显色时间/min
| 45
| 30
| 15
| 13
| 10
| 7
| 5
|
(7)由该表可以得出的结论是?
(8)请用化学反应原理解释?
2、实验题 (15分)工业上将纯净干燥的氯气通入到物质的量浓度为0.375 mol·L-1NaOH溶液中得到漂白水。某同学想在实验室探究Cl2性质并模拟制备漂白水,下图是部分实验装置。已知KMnO4与盐酸溶液反应可以制取Cl2。
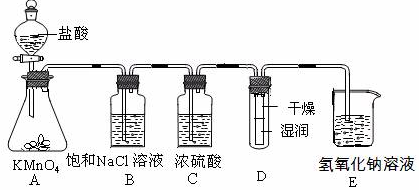
(1)配制物质的量浓度为0.375 mol·L-1NaOH溶液100mL时, 用托盘天平称取所需的NaOH质量为 ?。
(2)浓硫酸的作用是 ? 。
(3)装置E中发生化学反应方程式为 ? 。
(4)装置B中饱和NaCl溶液的作用是?。
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色。该同学认为Cl2的密度比空气大,可能是试管下部Cl2的浓度大于试管上部Cl2的浓度所导致的。请判断该解释是否合理,并分析产生上述实验现象的原因 ?
? ;如需改进,请简述设计方案 ? (若认为合理。则此问可不作答)。
(6)氯元素含量为10%的漂白水溶液355g,其中含NaClO的物质的量为 mol。
3、实验题 试用简单的实验证明,在醋酸溶液中存在着CH3COO HCH3COO-+H+的电离平衡(要求写出简单操作、现象及实验能说明的问题)。
HCH3COO-+H+的电离平衡(要求写出简单操作、现象及实验能说明的问题)。
4、实验题 请设计CO2在高温下与木炭反应生成CO的实验。
?(1)在下面方框中,A表示由长颈漏斗和锥形瓶组成的气体发生器,请在A后完成该反应的实验装置示意图(夹持装置、连接胶管及尾气处理部分不必画出,需要加热的仪器下方用△标出),按气流方向在每件仪器下方标出字母B、 C……;其他可选用的仪器(数量不限)简易表示如下:
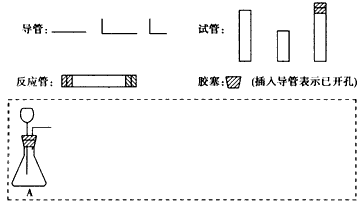
(2)根据方框中的装置图,填写下表

(3)有人对气体发生器作如下改进:在锥形瓶中放人一小试管,将长颈漏斗下端插入小试管中。改进后的优点是_________________________________________________;
(4)验证CO的方法是_____________________________________________。
5、实验题 三氧化二铁和氧化亚铜是红色粉末,常作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fc2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料知:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设:假设l:红色粉末是Fc2O3?假设2:红色粉末是Cu2O
假设3:红色粉末是Fc2O3和Cu2O的混合物
设计实验:取少量粉末放人足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(1)若假设1成立,则实验现象是__??。
(2)若滴入 KSCN溶液后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?____。筒述你的理由?.
(3)若固体粉末完全溶解无固体存在,滴加KSCN溶液时溶液不变红色,则证明原固体粉末是Fc2O3,和Cu2O的混合物,则其质量比为____,写出其中发生的氧化还原反应的离子方程式?。探究延伸:经实验分析,确定红色粉末为Fc2O3,和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg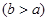 ,则混合物中Cu2O的质量分数为?。
,则混合物中Cu2O的质量分数为?。
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知在溶液中通过调节溶液的酸碱性而使Cu2+、Fe3+、Fe2+分别生成沉淀的pH如下:
物?质
| Cu(OH)2
| Fe(OH)2
| Fe(OH)3
|
开始沉淀pH
| 6.0
| 7.5
| 1.4
|
沉淀完全pH
| 13
| 14
| 3.7
|
?
实验室有下列试剂可供选择: A.氯水? B.H2O2? C.NaOH ? D.Cu2(OH)2CO3
实验小组设计如下实验方案:
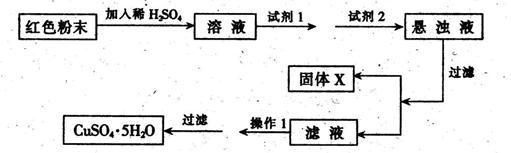
试回答:①试剂1为___?_,试剂2为?(填字母)。
②固体X的化学式为____,③操作I为_?。