微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 发展“碳一化学”,开发利用我国相对丰富的煤炭资源具有重要的战略意义和经济价值.下面是以焦炭为原料,经“碳一化学”途径制取乙二醇的过程:
(1)该过程中产生的CO可继续与水蒸气发生可逆反应得到CO2和H2,此反应的平衡常数表达式K=______.
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,请写出CH3OH(l)完全燃烧的热化学方程式______.
(3)“催化还原”反应制乙二醇原理如下:CH3OOC-COOCH3(g)+4H2(g)?HOCH2-CH2OH(g)+2CH3OH(g)△H=-34kJ/mol
为探究实际生产的最佳条件,某科研小组进行了多方面研究.如图表示乙二醇达到平衡时的产率随原料投料比[n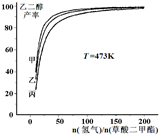 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=______.
(4)草酸二甲酯水解产物草酸(H2C2O4)为二元中强酸
①草酸氢钾溶液中存在如下平衡:H2O?H++OH-、HC2O4-?H++C2O42-和______.
②向0.1mol/L的草酸氢钾溶液里滴加NaOH溶液至中性,此时溶液里各粒子浓度关系正确的是______(填序号).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.c(Na+)=c(H2C2O4)+c(C2O42-)d.c(K+)>c(Na+)
(5)以甲醇为原料,使用酸性电解质构成燃料电池,该燃料电池的负极反应式为______;若以甲烷代替该燃料电池中的甲醇,向外界提供相等电量,则每代替32g甲醇,所需标准状况下的甲烷的体积为______L.
参考答案:(1)CO(g)+H2O(g)?CO2(g)+H2(g)的化学平衡常数K=c(CO2)×c(H2)c(CO)×c(H2O),
故答案为:c(CO2)×c(H2)c(CO)×c(H2O);
(2)CH3OH(l)气化时吸收的热量为27kJ/mol,CH3OH(g)的燃烧热为677kJ/mol,则CH3OH(l)的燃烧热为677kJ/mol-27kJ/mol=650kJ/mol,故CH3OH(l)完全燃烧的热化学方程式为:
CH3OH(l)+3/32O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol
故答案为:CH3OH(l)+3/32O2(g)=CO2(g)+2H2O(l)△H=-650kJ/mol;
(3)由图象可知,曲线甲表示的乙二醇的产率最大,原料投料比[n(氢气)/n(草酸二甲酯)]一定时,由方程式可知,正反应是体积减小的反应,增大压强平衡向正反应移动,平衡时乙二醇的产率增大,故曲线甲对应的压强是P(甲)=3.5MPa,
故答案为:3.5MPa;
(4)①H2C2O4为二元中强酸,HC2O4-在溶液中发生电离与水解,还存在平衡:HC2O4-+H2O?H2C2O4+OH-,
故答案为:HC2O4-+H2O?H2C2O4+OH-;
②a.碳元素在溶液中存在形式有:HC2O4-、H2C2O4、C2O42-,根据物料守恒由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-),故a正确;
b.根据电荷守恒有:c(K+)+c(Na+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),溶液呈中性,则c(H+)=c(OH-),故c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-),故b错误;
c.由c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)、c(K+)+c(Na+)=c(HC2O4-)+2c(C2O42-)可知,
c(Na+)=c(C2O42-)-c(H2C2O4),故c错误;
d.若恰好反应,c(K+)=c(Na+),此时溶液呈碱性,故加入的氢氧化钠的物质的量略少些,故c(K+)>c(Na+),故d正确;
故答案为:ad;
(5)总反应式为2CH3OH+3O2(g)=2CO2(g)+4H2O,正极是还原反应,氧气在正极放电,酸性条件下获得电子生成水,正极电极反应式为:3O2+12H++12e-=6H2O,总反应式减去正极反应式可得负极电极反应式为:2CH3OH+2H2O-12e-=2CO2+12H+,即CH3OH+H2O-6e-=CO2+6H+,
32g甲醇的物质的量为为32g32g/mol=1mol,完全燃烧转移电子数为1mol×6=6mol,故需要甲烷的物质的量为6mol8=0.75mol,需要甲烷的体积为0.75mol×22.4L/mol=16.8L,
故答案为:CH3OH+H2O-6e-=CO2+6H+;16.8.
本题解析:
本题难度:一般
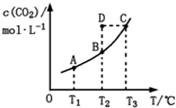
2、选择题 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
A.反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0
B.在T2时,若反应处于状态D,则一定有ν正<ν逆
C.平衡状态A与C相比,平衡状态A的c(CO)小
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2