微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 当钠、钾等金属不慎着火时,可以用来灭火的是:(?)
A.水
B.煤油
C.沙子
D.泡沫灭火剂
参考答案:C
本题解析:钠、钾均是活泼的金属,极易和水反应,生成氢气,A不正确;煤油易燃烧,B不正确;钠、钾燃烧可以生成过氧化物,泡沫灭火器能喷出CO2,而CO2能和过氧化物反应生成氧气,D不正确,答案选C。
点评:该题主要是考查学生对钠、钾性质的熟悉了解程度,特别是安全事故的应急处理措施,有利于调动学生的学习兴趣,培养学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
2、实验题 (10分)现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
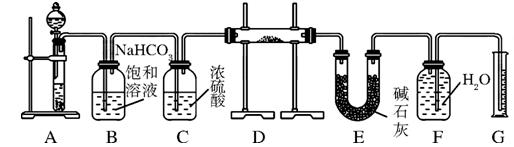
回答下列问题:
(1)装置A中液体试剂选用____________,理由是__________________________。
(2)装置B的作用是___________________,装置E中碱石灰的作用是___________。
(3)装置D中发生反应的化学方程式是:____________________、_______________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。
参考答案:(1)6 mol/L盐酸(2分) 硫酸与CaCO3固体反应生成的CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续(2分)
(2)除去气体中的HCl(2分)?吸收装置D中反应剩余的CO2(2分)
(3)2Na2O2+2CO2=2Na2CO3+O2(2分)、Na2O+CO2=Na2CO3(2分)
(4)78%(2分)
本题解析:(1)装置A是碳酸钙和盐酸反应生成二氧化碳,碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸来反应,
故答案为:6mol/L盐酸,硫酸和碳酸钙反应生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续;
(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以将二氧化碳干燥,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰,
故答案为:除去气体中的HCl;吸收装置D中反应剩余的二氧化碳;
(3)氧化钠和过氧化钠和二氧化碳反应的原理方程式分别为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3,
故答案为:2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3;
(4)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02ml,
过氧化钠的纯度= 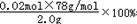 =78%,故答案为:78%.
=78%,故答案为:78%.
点评:本题考查学生过氧化钠的化学性质知识,通过实验方式考查增加了难度,综合性较强。
本题难度:一般
3、选择题 铷和另一种碱金属的合金7.8 g,与足量水完全反应后,放出氢气0.20 g,则合金中另一种碱金属可能是(?)
A.Li
B.Na
C.K
D.Cs
参考答案:AB
本题解析:题目中所涉及的金属均为碱金属,可写出合金与水反应的通式,通过求平均相对原子质量来确定另一种碱金属的种类。
因合金由碱金属组成,故设合金为M,平均相对原子质量为x,
2M+2H2O====2MOH+H2↑
2x? 2
7.8 g? 0.2 g
2x∶2="7.8" g∶0.2 g? x=39
因为铷的相对原子质量大于39,所以另一碱金属的相对原子质量必小于39,Li、Na的相对原子质量分别为6.9、23,符合题意。
本题难度:简单
4、选择题 过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28 g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)(?)
?
| 二氧化碳
| 碳酸钠
| 转移的电子
|
A
| 1 mol
| ?
| 2NA
|
B
| 22.4 L
| 1 mol
| ?
|
C
| ?
| 106 g
| 1 mol
|
D
| ?
| 106 g
| 2NA
|
?
参考答案:C
本题解析:解答本题可写出CO2和Na2O2反应的化学方程式,列出物质的各物理量的对应关系,根据差量法求出各物理量的对应数值,与各选项比较。
根据化学反应方程式计算
2Na2O2+2CO2=2Na2CO3+O2~2e-~Δm
88 g? 212 g? 2NA? 56 g
44 g? 106 g? NA? 28 g
由反应后固体质量增加了28 g可知反应的CO2物质的量为1 mol,质量为44 g,转移电子数为NA,生成的Na2CO3的物质的量为1 mol,质量为106 g。因为是常温常压,CO2的体积不是22.4 L,故只有C项正确。
本题难度:一般
5、选择题 下列关于碱金属元素的叙述正确的是(?)
A.它们都能在空气中燃烧生成M2O
B.它们失去电子的能力很强,故在自然界中无游离态存在
C.它们的焰色反应都是黄色
D.它们都能与水反应生成碱和氢气
参考答案:BD
本题解析:碱金属元素在空气中燃烧,Na生成了Na2O,则K、Rb、Cs都生成了比较复杂的化合物,故选项A是错的,选项B是正确的。只有Na的焰色反应才是黄色的,而其他碱金属元素的焰色反应却不是这样的,故C项是错误的。碱金属元素与水反应是剧烈的,都能生成碱和氢气,所以D项是正确的。
本题难度:简单