微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 铜与1mol/L的硝酸反应,如果硝酸根的浓度下降0.2mol/L,则溶液中的c(H+)同时下降
A.0.2mol/L
B.0.4mol/L
C.0.6mol/L
D.0.8mol/L
参考答案:D
本题解析:由于硝酸被还原生成NO,因此硝酸根离子浓度会减小.根硝酸与铜反应的离子方程式:3Cu+8H++2NO3— ="3Cu" 2++ 2NO + 4H2O,反应中消耗的硝酸根离子与氢离子的物质的量之比为1:4.因此正确选项为D(0.8mol/L). 或者:由于硝酸根离子转化为NO,在转化过程中,每个NO3—失去了两个O,与4个H+结合转化为H2O。因此当硝酸根离子浓度减小0.2mol/L时,H+的浓度减小0.8mol/L.
本题难度:简单
2、计算题 室温时,将盛有20mLNO2和O2混合气体的量筒倒立于盛有水的水槽中,一会儿,量筒里留下 3mL气体。则原混合气体中NO2为多少毫升?</PGN0004B.TXT/PGN>
参考答案:
(1)当留下3mL气体为O2时,设混合气体含NO2xmL。
4NO2+O2+2H2O=4HNO3
4mL 1mL
xmL x/4mL
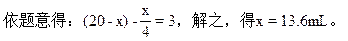
(2)当留下3mL气体为NO时,设混合气体中含O2ymL。
4NO2+O2+2H2O=4HNO3?3NO2+H2O=2HNO3+NO
4mL? 1mL? 3mL? 1mL
4ymL? ymL? (20-5y)mL? 1/3×(20-5y)mL
依题意得:1/3×(20-5y)=3,解之得:y=2.2mL,NO2为:20-2.2=17.8mL。
本题解析:最后留下3mL气体,有两种情况,一是过量的氧气,二是一氧化氮。因此必须分两种情况讨论求解。
(1)当留下3mL气体为O2时,设混合气体含NO2xmL。
4NO2+O2+2H2O=4HNO3
4mL 1mL
xmL x/4mL
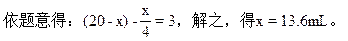
(2)当留下3mL气体为NO时,设混合气体中含O2ymL。
4NO2+O2+2H2O=4HNO3?3NO2+H2O=2HNO3+NO
4mL? 1mL? 3mL? 1mL
4ymL? ymL? (20-5y)mL? 1/3×(20-5y)mL
依题意得:1/3×(20-5y)=3,解之得:y=2.2mL,NO2为:20-2.2=17.8mL。
本题难度:一般
3、选择题 将一定体积的稀硝酸溶液平均分成两份,一份与足量的铜粉反应收集到气体的体积V1 ,另一份先加入与其等体积的稀硫酸,再投入足量的铜粉收集到的气体的体积为V2 (V1与V2都是在同一条件下测定)。已测得2 V1=V2,则稀硝酸与稀硫酸的物质的量浓度之比为
A.1:1
B.3:1
C.2:1
D.任意比
参考答案:C
本题解析:设每份硝酸中硝酸的物质的量为a mol
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
第一份硝酸中产生的NO的物质的量为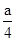 mol(H+全部参加反应,可由其计算)
mol(H+全部参加反应,可由其计算)
第二份硝酸由硫酸补充了部分H+,如果溶液中的NO3-全部被还原,则可得到NO为a mol,不符合题意,故NO3-没有全部参加反应;
设硫酸溶液中硫酸的物质的量为b mol,溶液中H+共(a+2b)mol,可得到NO为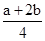 mol
mol
由题意知: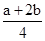 =2×
=2×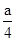 ,即a=2b
,即a=2b
由于两溶液等体积,故硝酸的浓度硫酸的两倍,答案为C
本题难度:一般
4、选择题 将导出H2S气体的导管点燃后伸入盛有一定量O2的集气瓶内,下列3个反应发生的先后顺序是
① 2H2S + O2 → 2S + 2H2O?② 2H2S + SO2 → 3S + 2H2O?③ 2H2S + 3O2 → 2SO2 + 2H2O
A.①②③
B.③①②
C.①③②
D.③②①
参考答案:B
本题解析:开始氧气充足,随着反应的进行,氧气的量越来越少,故发生的反应为③②①
本题难度:一般
5、选择题 下列对硝酸的认识不正确的是
A.打开浓硝酸的瓶盖会冒白雾
B.锌跟稀硝酸的反应是置换反应
C.常用硝酸来制炸药、化肥等
D.稀硝酸也是一种强氧化性酸
参考答案:B
本题解析:本题主要考查硝酸的性质和用途。硝酸属于挥发性酸,而且硝酸越浓越易挥发,挥发出来的硝酸蒸汽遇水蒸气形成白雾,A正确;硝酸属于氧化性酸,稀硝酸与锌反应生成NO,而不是氢气,因而不是置换反应,B不正确,D正确;硝酸是重要的化工原料,常用来制备农药、化肥等,C正确。
本题难度:一般