微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在含Na2CO3和NaHCO3各1?mol的混合溶液中加入0.5?mol下列物质,其中能使HCO3―的数目均减少,CO32―数目增加的是
A.浓盐酸
B.Na2SO4浓溶液
C.NaOH浓溶液
D.Ba(OH)2浓溶液
参考答案:CD
本题解析:
本题难度:简单
2、选择题 下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸在常温下能够使铁、铝钝化
D.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
参考答案:C
本题解析:分析:A.浓硫酸具有脱水性,可使蔗糖炭化;
B.浓硫酸和铜在加热条件下发生反应;
C.浓硫酸具有强氧化性,可使铁、铝钝化;
D.氨气为碱性气体,不能用浓硫酸干燥.
解答:A.蔗糖中不含水,蔗糖碳化是由于浓硫酸具有脱水性的原因,故A错误;
B.浓硫酸和铜在加热条件下发生反应,常温下不反应,故B错误;
C.浓硫酸具有强氧化性,可使铁、铝在表面生成一层致密的氧化物膜,即钝化,故C正确;
D.氨气为碱性气体,不能用浓硫酸干燥,故D错误.
故选C.
点评:本题考查浓硫酸的性质,题目难度不大,本题注意浓硫酸脱水性和吸水性的区别,注意能用浓硫酸干燥的气体有哪些.
本题难度:简单
3、选择题 在标准状况下,取甲、乙、丙各100mL相同 浓度的盐酸,分别加入组成相同的镁铝合金粉末,得到的气体体积(标准状况)与合金的质量有关数据如下表;
A.甲组中盐酸过量,丙组中金属过量
B.盐酸的物质的量浓度为1mol/L
C.合金中镁,铝的物质的量之比是1:1
D.向甲容器中继续加入350mL1.00mol?L-1NaOH溶液时,生成沉淀0.1mol
参考答案:BD
本题解析:分析:甲中加入2.55g合金时生成气体的体积为2.80L,继续加入合金,最多生成3.36L气体,说明甲中盐酸过量,且生成气体最多为3.36L,根据反应的相关方程式计算.
解答:A.甲中加入2.55g合金时生成气体的体积为2.80L,继续加入合金,最多生成3.36L气体,说明甲中盐酸过量,金属不足,分别加入金属3.85g和4.59g时,生成气体的体积相等,则说明丙组中金属过量,故A正确;
B.不管加多少镁铝合金,最多只能生成3.36L的氢气,说明盐酸最多只能产生3.36L的氢气.所以就3.36L来计算盐酸的物质的量. 气体的物质的量为: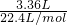 =0.15mol,
=0.15mol,
根据方程式,可计算出HCl的物质的量为0.15mol×2=0.3mol,盐酸的物质的量浓度为: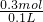 =3mol/L,故B错误;
=3mol/L,故B错误;
C.由于甲组中,盐酸是过量的,所以用甲组来计算,设Mg的物质的量为x,Al的物质的量为y,
生成气体的物质的量为: =0.125mol,
=0.125mol,
依题意得:24x+27y=2.55g;x+ y=0.125mol,
y=0.125mol,
解方程组得:x=0.05;y=0.05,
所以物质的量之比为1:1,
故C正确;
D.当甲中Mg2+、Al3+全部生成沉淀时,溶液的溶质为NaCl,已知n(Cl-)=0.15mol×2=0.3mol,则需1.00mol?L-1NaOH溶液
300ml,此时加入350mL1.00mol?L-1NaOH溶液,则有Al(OH)3+OH-=AlO2-+2H2O,所以沉淀的物质的量小于0.1mol,故D错误;
故选BD.
点评:本题考查混合物的计算,题目难度较大,注意根据表中数据判断合金与盐酸反应的过量问题为解答本题的关键.
本题难度:困难
4、选择题 下列物质中,和氢硫酸反应,但不能产生沉淀的是
A.Pb(NO3)2溶液
B.Na2S洛液
C.CuSO4溶液
D.稀H2SO4
参考答案:B
本题解析:试题分析:A中生成PbS沉淀,B中生成NaHS,C中生成CuS沉淀,D中不反应,答案选B。
考点:考查H2S的性质
点评:该题是识记性知识的考查,重点考查学生对H2S性质的熟悉了解程度,旨在考查学生灵活运用基础知识解决实际问题的能力,难度不大,熟练记住并能灵活运用即可。
本题难度:困难
5、选择题 为除去CuCl2溶液中的FeCl2,可先加入H2O2溶液,使Fe2+氧化为Fe3+,而后Fe3+再转化为Fe(OH)3沉淀,应该再加入的试剂是
A.NaOH溶液
B.Fe(OH)3晶粒
C.NH3?H2O
D.Cu(OH)2悬浊液
参考答案:D
本题解析:分析:因为Fe3+存在水解平衡:Fe3++3H2O?Fe(OH)3+3H+;应使平衡右移,需加入能与氢离子结合的物质且不引入新的杂质.
解答:A.引入了新的杂质钠离子,故A错误;
B.Fe(OH)3晶粒不能促进三价铁离子的水解,故B错误;
C.氨水能促进三价铁离子的水解生成铵根离子,引入了新的杂质铵根离子,故C错误;
D.加碱能使Cu2+、Fe3+都沉淀,可加入Cu(OH)2悬浊液,因为Fe3+存在水解平衡:Fe3++3H2O?Fe(OH)3+3H+.加入的Cu(OH)2把H+消耗,促使平衡正向移动,生成Fe(OH)3沉淀,故D正确.
故选D.
点评:本题考查化学平衡移动,题目难度不大,注意除杂不能引入新的杂质离子.
本题难度:简单