微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 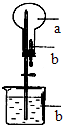 如图所示,在干燥的圆底烧瓶中充满某气体a,胶头滴管中吸有少量液体b,当把溶液b挤进烧瓶后,打开止水夹不能形成“喷泉”的组合是
如图所示,在干燥的圆底烧瓶中充满某气体a,胶头滴管中吸有少量液体b,当把溶液b挤进烧瓶后,打开止水夹不能形成“喷泉”的组合是
A.A
B.B
C.C
D.D
参考答案:D
本题解析:分析:氨气形成喷泉的原理是由于氨气极易溶于水,将胶体滴管内液体挤出,氨气溶于水而导致烧瓶内压强迅速减小,从而形成喷泉,依据氨气形成喷泉的原理,如要形成喷泉,烧瓶内气体溶于水或与胶头滴管内液体反应而导致烧瓶内压强减小,外界大气压将烧杯内液体压入到烧瓶内,从而形成喷泉.
解答:A、氨气和水反应生成氨水,导致烧瓶内压强减小,能形成喷泉,故A不选;
B、氯化氢极易溶于水,导致烧瓶内压强减小,能形成喷泉,B不选;
C、二氧化碳与氢氧化钠溶液反应生成碳酸钠,导致烧瓶内压强减小,能形成喷泉,故C不选;
D、饱和氯化钠溶液中含有氯离子能抑制氯气的溶解,所以氯气不能使烧瓶内压强减小,不能形成喷泉,故D选.
故选D.
点评:本题考查喷泉实验的发生原理,题目难度不大,本题注意理解形成喷泉的条件.
本题难度:一般
2、选择题 少量钠应保存在
A.密闭容器中
B.水中
C.煤油中
D.汽油中
参考答案:C
本题解析:试题分析:钠的性质很活泼,极易和空气中的氧气反应生成氧化钠,所以应密封保存;钠的密度小于煤油的密度,且和煤油不反应,所以金属钠通常保存在 煤油里,答案选C。
考点:考查钠的保存
点评:该题是常识性知识的考查,难度不大。明确钠的性质,然后有针对性的选择保存方法是答题的关键。
本题难度:困难
3、选择题 下列推断正确的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A、常温下铁在浓硫酸中发生钝化现象生成氧化物薄膜阻止反应进行;
B、碳酸钠溶液可以和二氧化碳水反应生成碳酸氢钠;
C、氧化铜分解生成氧化亚铜和氧气,氧化亚铜在酸中发生自身氧化还原反应生成铜盐和铜;
D、氧化剂氧化性的强弱是得到电子的能力大小,和被还原的价态无关.
解答:A、常温下铁在浓硫酸中发生钝化反应生成致密氧化物薄膜阻止反应进行,常温下铜不与浓硫酸反应不溶于浓硫酸,故A错误;
B、饱和碳酸钠溶液可以吸收氯化氢,也可以吸收二氧化碳生成碳酸氢钠,故B错误;
C、氧化铜分解生成氧化亚铜和氧气,氧化亚铜在酸中发生自身氧化还原反应生成铜盐和铜;证明氧化铜分解生成氧化亚铜,故C正确;
D、氧化剂氧化性的强弱是得到电子的能力大小决定,和被还原的价态无关,浓硝酸氧化性大于稀硝酸,故D错误;
故选C.
点评:本题考查了浓硫酸、氧化铜、碳酸钠性质的应用,反应现象的判断应用,氧化剂氧化性的强弱判断,题目难度中等.
本题难度:简单
4、选择题 用下列实验装置进行的实验,能达到相应的实验目的是
A.? 铜锌原电池
B.检验火柴头燃烧产生的SO2
C.? 分液操作
D.制取氨气
参考答案:D
本题解析:分析:A.离子不能向两极定向移动;
B.进气管太短,没有插入到液面以下;
C.分液漏斗下端应紧贴烧杯内壁;
D.氨气易挥发,碱石灰具有吸水作用.
解答:A.没有形成闭合回路,离子不能向两极定向移动,不能形成原电池,故A错误;
B.进气管太短,应将进气管插入到液面以下,故B错误;
C.分液漏斗下端应紧贴烧杯内壁,防止液体飞溅,故C错误;
D.水与生石灰反应放热,促进氨气挥发,碱石灰具有吸水作用,氨气密度比水小,可用向下排空法收集,故D正确.
故选D.
点评:本题综合考查化学基本操作,涉及原电池、物质的检验、分离以及制备等操作,侧重于学生化学设计和评价的能力的考查,为高考常见提醒,难度不大.
本题难度:简单
5、选择题 已知:NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
A.x的最小值为110
B.x的最小值为100
C.所加盐酸物质的量浓度为1.0mol/L
D.样品A中NaHCO3和Na2CO3·nH2O的物质的量分别为0.090mol和0.010mol
参考答案:B
本题解析:该题考查知识点为有关溶液物质的量浓度的计算。若纯粹考查计算会比较单一,结合反应和对数据的分析考查能体现学生分析问题的能力。
由表中数据,加入8 mL盐酸时没有二氧化碳气体生成,说明样品中含有Na2CO3·nH2O。发生反应的方程式为:Na2CO3·nH2O+HCl= NaHCO3+NaCl+nH2O…①,NaHCO3+HCl=CO2↑+NaCl+H2O…②。当加入15mL盐酸时生成112 mLCO2气体,当加入20mL盐酸时生成224 mLCO2气体,可得出当Na2CO3·nH2O与HCl完全生成NaHCO3之后,每加入5mL盐酸就生成112 mLCO2气体;由此可得出当样品中开始加入10mL盐酸时只发生反应①,当生成2240mLCO2时,对应100mL盐酸,再加上开始时加入的10mL,可得当生成2240mLCO2时,加入的盐酸的总体积为110mL,该体积即为生成2240mLCO2时的最小值。标况下2240mLCO2的物质的量为0.1mol,由反应②可得消耗NaHCO3的物质的量为0.1mol,消耗HCl的物质的量为0.1mol,该反应中消耗HCl的体积为100mL,则盐酸的物质的量浓度为1.0 mol/L。反应①中消耗HCl的体积为10mL,其物质的量为0.01mol,所以Na2CO3·nH2O的物质的量为0.01mol,同时生成0.01molNaHCO3,所以样品中NaHCO3的物质的量为0.1mol-0.01mol=0.09mol。
本题难度:简单