微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,1 molX和n mol Y在体积为2L的密闭容器中发生如下反应:X(g)+Y(g)=2Z(g)+M(s),5min后达到平衡,此时生成2a mol Z.下列说法正确的是( )
A.用X表示此反应的反应速率是(0.1-0.2a)mol?(L?min)-1
B.当混合气体的质量不再发生变化时,说明反应达到平衡状态
C.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
D.向上述平衡体系中再充入1mol X,v(正)增大,v(逆)减小,平衡正向移动
参考答案:A.5min后达到平衡,生成2amolZ,则参加反应的X的物质的量为2amol×12=amol,故v(X)=amol2L5min=0.1amol/(L?min),故A错误;
B.随反应进行,反应混合气体的质量减小,混合气体的质量不变,说明到达平衡,故B正确;
C.因固体和纯液体改变它的物质的量并不会改变它的浓度,因此化学平衡并不移动,故C错误;
D.向上述平衡体系中再充入1molX,反应物的浓度增大,生成物的浓度不变,所以v(正)增大,v(逆)不变,平衡向正反应移动,故D错误;
故选B.
本题解析:
本题难度:简单
2、简答题 利用天然气合成氨的工艺流程示意图如图1所示:
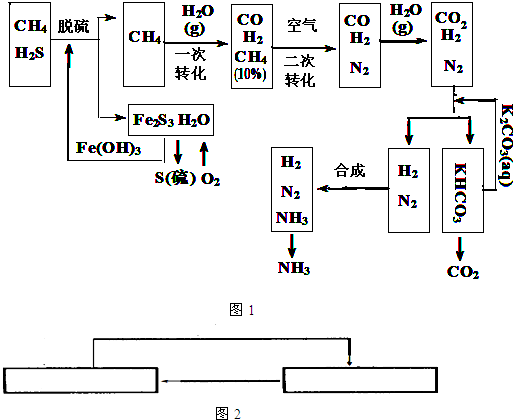
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是______.
(2)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是______(多选扣分).
(a)相似相溶原理?(b)勒沙特列原理?(c)酸碱中和原理
(3)由KHCO3分解得到的CO2可以用于______(写出CO2的一种重要用途).
(4)整个流程有三处循环,一是Fe(OH)3循环,二是K2CO3(aq)循环,请在图2中标出上述流程图第三处循环(循环方向、循环物质).
(5)在一定温度和压强的密闭合成反应器中,H2和N2混合气体平均相对分子质量为8.5,当该反应达到平衡时,测出平衡混合气的平均式量为10,请计算此时H2的转化率(写出计算过程):______.
参考答案:(1)硫化氢是酸性气体,可以和碱氢氧化铁发生中和反应:3H2S+2Fe(OH)3→Fe2S3+6H2O,
故答案为:3H2S+2Fe(OH)3═Fe2S3+6H2O;
?(2)K2CO3(aq)和CO2反应生成碳酸氢钾,增大压强,化学平衡向右进行,符合化学平衡移动原理,故答案为:b;
(3)二氧化碳可以和氢氧化钠反应生碳酸钠,固体二氧化碳干冰易升华可以做制冷剂,故答案为:生产纯碱(或作制冷剂等);
(4)上述流程图第三处循环使用的物质是氮气和氢气,即

,故答案为:

;
(5)设充入气体总量为1mol,氮气为x,则氢气为(1-x).
则有:28x+2(1-x)=8.5解得:N2:x=0.25mol?H2:1mol-0.25mol=0.75mol
又设平衡时N2转化y,则:
?N2 +3H2?2NH3
起始?0.25mol? ?0.75mol? ?0
变化?y? ?3y? ?2y
平衡?(0.25-y)mol?(0.75-3y)mol?2ymol
则有:28×(0.25-y)mol+2×(0.75-3y)mol+17×2ymol(0.25-y)mol+(0.75-3y)mol+2ymol=10
解得:y=0.075mol
则氢气的转化率为:3×0.075mol0.75mol×100%=30.0%.
答:此时H2的转化率为30%.
本题解析:
本题难度:一般
3、选择题 某温度下,在容积固定不变的密闭容器中进行如下可逆反应:X(g)+Y(g)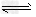 Z(g)+W(s) ΔH>0 一段时间后,达到化学平衡状态.下列叙述正确的是
Z(g)+W(s) ΔH>0 一段时间后,达到化学平衡状态.下列叙述正确的是
[? ]
A.通入稀有气体,平衡向正反应方向移动
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.降低温度,平衡向逆反应方向移动
参考答案:D
本题解析:
本题难度:一般
4、选择题 一定条件下,体积为5L的密闭容器中,0.5molX和0.5molY进行反应:2X(g)+Y(g) 2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是
2Z(g),经60s达到平衡,生成0.2molZ。下列说法正确的是
[? ]
A、将容器体积变为10L,Z的平衡浓度变为原来的1/2
B、在该温度下,该反应的平衡常数K=0.011
C、达到平衡时,容器内气体的压强是原来的90%
D、若降低温度,X的体积分数增大,则该反应的△H<0
参考答案:C
本题解析:
本题难度:一般
5、填空题 N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是________________
(2)2N2O5(g)→4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将_______(填“增大”、“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
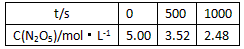
则500 s内N2O5的分解速率为_________
③在T3温度下,反应1000 s时测得NO2的浓度为4.98 mol·L-1,则T2______T1
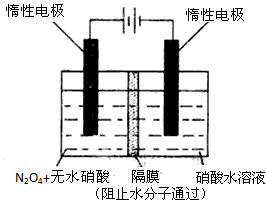
(3)下图所示装置可用于制备N2O5,则N2O5在电解池的_________区生成,其电极反应式为
_______________
参考答案:(1)“略”
(2)①不变;②0.00296 mol·L-1·s-1;③“<”或“小于”
(3)阴极;N2O4+2HNO3-2e-=2N2O5+2H+
本题解析:
本题难度:一般