微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 T℃时,在1L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)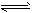
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。测得H2和CH3OH的浓度随时间的变化情况如下表所示。

下列说法不正确的是
[? ]
A.t0~t1时间内,v(H2)=3/(t1-t0)mol/(L·min)
B.T℃时,平衡常数K=1/27,CO2与H2的转化率相等
C.t0时,v(正)>v(逆)
D.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率
参考答案:D
本题解析:
本题难度:一般
2、简答题 在100℃和200kPa的条件下,反应aA(g)?bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步压缩体系的体积,增大体系的压强(维护温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
| 压强(kPa) | 200 | 500 | 1000
B的浓度(mol/L)
0.04
0.1
0.27
|
根据表中的数据,回答下列问题:
(1)压强从200kPa增加到500kPa时,平衡______移动(填“正向”或“逆向”或“不”),理由是______.
(2)压强从500kPa增加到1000kPa时,平衡______移动(填“正向”或“逆向”或“不”),其原因可能为______.
参考答案:(1)根据表中数据,压强从 200kPa增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明浓度增大的倍数和压强增大的倍数相同,化学计量数满足a=b+c,改变压强化学平衡不移动,
故答案为:不移动;浓度增大的倍数和压强增大的倍数相同;
(2)利用表中数据可知,压强增大的倍数为1000kPa/500kPa=2,B的浓度增大的倍数为0.27mol/L/0.1mol/L=2.7,浓度增大的倍数大于压强增大的倍数,说明加压至1000kPa时,C物质变成了非气态物质,所以增大压强化学平衡向“正向”移动,
故答案为:正向;加压至1000kPa时,C物质变成了非气态物质.
本题解析:
本题难度:简单
3、选择题 如下图所示,左侧注射器吸入10mLNO2?、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)?
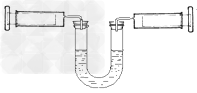
[? ]
A.左侧气体颜色先变深后逐渐变浅(比原来深)
B.对于2NO2 ?N2O4平衡体系,向生成N2O4的方向移动
?N2O4平衡体系,向生成N2O4的方向移动
C.压缩后U型管内左侧液面下降,右侧液面上升
D.若将两侧注射器活塞重新拉到10mL的位置,平衡后U型管两侧液面仍然保持水平
参考答案:C
本题解析:
本题难度:一般
4、选择题 用于净化汽车尾气的反应:2NO(g)+2CO(g)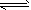 2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是
[? ]
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570 K时该反应正向进行的程度很大,故使用催化剂并无实际意义
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列说法中正确的是( )
A.可逆反应的特征是正反应速率和逆反应速率相等
B.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动
C.在其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态
D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态
参考答案:A、化学平衡状态的特征之一是正反应速率和逆反应速率相等的状态,故A错误;
B、根据化学平衡移动原理:升高温度可以使化学平衡向吸热反应的方向移动,故B错误;
C、增大压强会破坏有气体存在并且反应前后气体体积变化的反应的平衡状态,对反应前后气体体积不变的反应无影响,故C错误;
D、使用催化剂可以改变化学反应速率,但不能改变化学平衡状态,故D正确.
故选D.
本题解析:
本题难度:简单