微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列顺序表述正确的是
A.酸性:H3PO4> HNO3> HClO4
B.稳定性:H2O > HF > H2S
C.原子半径:Na > Mg > O
D.还原性:F-> Cl-> S2-
参考答案:C
本题解析:A 错误,酸性:HClO4?> HNO3?> H3PO4?
B 错误,稳定性: HF > H2O > H2S?
C 正确。
D 错误,还原性: S2-?> Cl-> F-
本题难度:一般
2、选择题 X、Y两种元素可形成X2Y3型化合物,则X和Y原子最外层的电子排布可能是(? )
A.X:3s23p1 Y:3s23p5
B.X:2s22p3 Y:2s22p4
C.X:3s23p1 Y:3s23p4
D.X:3s2 Y:2s22p3
参考答案:B、C
本题解析:根据最外层电子排布写出对应的元素,一一排除。
本题难度:一般
3、选择题 关于铯(Cs)及其化合物的性质,说法正确的是(?)
A.金属铯的熔点比金属钠高
B.CsOH比NaOH的碱性强
C.CsOH是一种弱碱
D.碳酸铯难溶于水
参考答案:B
本题解析:略
本题难度:一般
4、选择题 X、Y、Z、W是原子序数依次增大的短周期主族元素,X、Z在周期表中的相对位置如右下表。已知:X元素最低负化合价的绝对值与其原子最外层电子数相等,Y是地壳中含量最多的金属元素。下列说法错误的是?(?)
X
| ?
| ?
| 
| ?
|
?
| ?
| Z
| ?
| ?
|
?
A.X和氢组成的化合物分子中可能含有极性共价键和非极性共价键
B.工业上用电解Y和W组成的化合物来制备Y
C.Z、W两元素的气态氢化物中,W的气态氢化物更稳定
D.X、Y、Z、W元素最高价氧化物对应的水化物中酸性最强的是HWO4
参考答案:B
本题解析:略
本题难度:一般
5、填空题 四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
?
| W
| X
| Y
| Z
|
结构或性质
| 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物
| 焰色反应呈黄色
| 在同周期主族元素形成的简单离子中,离子半径最小
| 最高正价与最低负价之和为零
|
?
(1)Z在元素周期表中位于?族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是?(填元素符号)。
(3)①下列可作为比较X和Y金属性强弱的依据是?(填序号)。
A.自然界中的含量? B.单质与酸反应时失去的电子数
C.单质与水反应的难易程度?D.最高价氧化物对应水化物的碱性
②从原子结构的角度解释X的金属性强于Y的原因:?,原子半径X>Y,所以原子核对最外层电子的吸引力X<Y,失电子能力X>Y。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物的溶液混合,反应的化学方程式是?。
(5)Y单质和Mg组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。能确定混合物中Y的质量分数的数据有?(填序号)。
A.m、n ?B.m、y?C.n、y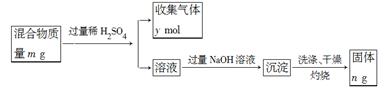
参考答案:(1)ⅣA?(2)Na ?(3)①C D?②电子层数相同,质子数Y > X
(4)HN3+NaOH=NaN3+H2O?(5)A B C
本题解析:根据题意可推出W是N;X是Na;Y是Al ;? Z 是Si 。(1)Si核外电子排布为2、8、4。所以它在元素周期表中位于第三周期第ⅣA。(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,这种物质是NaOH。则该元素是Na。(3)①Na、Al都是金属元素,可以通过其单质与水反应置换出氢的难易程度比较;也可以通过比较最高价氧化物对应水化物的碱性强弱。但不能看其原子失去电子的多少或自然界中的含量的多少。。因此选项为CD。②Na、Al都是第三周期的元素,原子核外的电子层数相同,但由于质数Al>Na。原子序数越大,原子半径就越小,原子失去电子就越难,元素的金属性就越弱。所以金属性Na >Al。(4)HN3酸性与醋酸相似,则它是弱酸。酸碱中和生成盐和水。则HN3与NaOH反应的方程式为HN3+NaOH=NaN3+H2O。(5) 有关反应的方程式为Mg+H2SO4=MgSO4+H2↑; 2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑;当加足量的NaOH溶液时发生反应:AlCl3+4NaOH= NaAlO2+3NaCl+2H2O; MgSO4+2NaOH= Mg(OH)2↓+Na2SO4。得到的沉淀是Mg(OH)2.将其过滤、洗涤、干燥后灼烧发生分解反应得到MgO。Mg(OH)2 MgO+H2O。A.根据MgO的质量n可计算出其中的Mg元素的质量,再用Mg、Al的总质量减去Mg元素的质量即得到Al的质量,从而求出Al的质量分数。正确。B.假设Mg、Al的物质的量分别为a、b。则根据题意可得24a+27b=m;a+3/2b=y.两式联立就可计算出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。C.根据MgO的质量n可计算出其中的Mg元素的质量,利用n=m/M计算出Mg的物质的量。根据Mg+H2SO4=MgSO4+H2↑知道其放出H2的物质的量。再用n(H2)(Al)=n(H2)(总)- n(H2)(Mg).根据2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑可求出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。
MgO+H2O。A.根据MgO的质量n可计算出其中的Mg元素的质量,再用Mg、Al的总质量减去Mg元素的质量即得到Al的质量,从而求出Al的质量分数。正确。B.假设Mg、Al的物质的量分别为a、b。则根据题意可得24a+27b=m;a+3/2b=y.两式联立就可计算出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。C.根据MgO的质量n可计算出其中的Mg元素的质量,利用n=m/M计算出Mg的物质的量。根据Mg+H2SO4=MgSO4+H2↑知道其放出H2的物质的量。再用n(H2)(Al)=n(H2)(总)- n(H2)(Mg).根据2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑可求出Al的物质的量,进而得出Al的质量,从而求出Al的质量分数。正确。
本题难度:一般