微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.
①铝土矿的主要成分是Al2O3和SiO2等.从铝土矿中提炼Al2O3的流程如图1所示:

②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如图2所示:
回答下列问题:
(1)写出反应1的化学方程式______;
(2)滤液Ⅰ中加入CaO生成的沉淀是______,反应2的离子方程式为______;
(3)E可作为建筑材料,化合物C是______,写出由D制备冰晶石的化学方程式______;
(4)电解制铝的化学方程式是______,以石墨为电极,阳极产生的混合气体的成分是______.
参考答案:(1)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:2NaOH+SiO2=Na2SiO3+H2O,氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:2NaOH+Al2O3=2NaAlO2+H2O,
故答案为:2NaOH+SiO2=Na2SiO3+H2O、2NaOH+Al2O3=2NaAlO2+H2O;
(2)滤液Ⅰ中含有硅酸钠、偏铝酸钠,加入CaO,生成氢氧化钙,氢氧化钙与硅酸钠反应生成硅酸钙沉淀;
由工艺流程可知,B为氢氧化铝,故气体A为二氧化碳,滤液Ⅱ主要是偏铝酸钠,偏铝酸钠溶液通入二氧化碳,生成氢氧化铝与碳酸钠,反应方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:CaSiO3;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(3)由工艺流程可知,气体C含有F元素,应是HF,故C为浓硫酸;根据元素守恒,可知HF与碳酸钠、氢氧化铝反应生成冰晶石,同时生成二氧化碳、水,反应方程式为:12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O,
故答案为:浓H2SO4;12HF+3Na2CO3+2Al(OH)3=2Na3AlF6+3CO2+9H2O;
(4)电解熔融的氧化铝生成铝与氧气,反应方程式为:2Al2O3(熔融)?通电?.冰晶石4Al+3O2↑,阳极生成氧气,部分氧气可以石墨反应生成二氧化碳、CO,故阳极气体有O2、CO2(或CO)
故答案为:2Al2O3(熔融)?通电?.冰晶石4Al+3O2↑;O2、CO2(或CO).
本题解析:
本题难度:一般
2、填空题 据说古代有一队运输纯碱的车队,夜晚在沙滩上用纯碱块和石块打起炉灶烧火做饭,第二天清晨日出时,在炉灶处发现有些明晃晃的东西.
(1)你认为明晃晃的东西是______.
(2)写出整个过程中的化学方程式:______.
参考答案:(1)沙滩中沙子含有二氧化硅,石块中含有碳酸钙,二氧化硅、碳酸钠、碳酸钙在高温下能生成明晃晃的玻璃,故答案为:玻璃;
(2)二氧化硅与碳酸钠在高温下产生硅酸钠和二氧化碳,方程式为Na2CO3+SiO2高温.Na2SiO3+CO2↑,二氧化硅与碳酸在高温下产生硅酸钙和二氧化碳:CaCO3+SiO2高温.CaSiO3+CO2↑
故答案为:Na2CO3+SiO2高温.Na2SiO3+CO2↑、CaCO3+SiO2高温.CaSiO3+CO2↑;
本题解析:
本题难度:一般
3、选择题 硅及其化合物在材料领域中应用广泛。下列叙述中,正确的是
[? ]
A.晶体硅是良好的半导体材料
B.硅是地壳中含量最多的元素
C.SiO2不溶于水,也不溶于任何酸
D.用带玻璃瓶塞的试剂瓶盛放NaOH溶液
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列产品主要成分为二氧化硅的是
[? ]
A.计算机芯片
B.太阳能电池
C.水玻璃
D.光导纤维
参考答案:D
本题解析:
本题难度:简单
5、选择题 向一无色透明的溶液中滴加稀硫酸时有沉淀生成且所得沉淀量与所加硫酸的关系如图所示, 则原溶液可能是
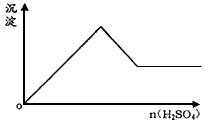
[? ]
A.Na2SiO3与Na2CO3的混合溶液
B.NaAlO2与Na2S2O3的混合溶液
C.AlCl3与CuSO4的混合溶液
D.Na2SO3与Na2S的混合溶液
参考答案:B
本题解析:
本题难度:简单