微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 甲、乙是同周期的非金属元素,若原子半径甲大于乙,则下列四种叙述中正确的是( )
A.最高价氧化物的水化物的酸性甲比乙强
B.气态氢化物的稳定性甲比乙弱
C.阴离子的还原性甲比乙弱
D.非金属性甲比乙强
参考答案:同周期原子从左到右原子半径逐渐减小,若原子半径甲大于乙,则原子序数乙大于甲,则
A.同周期元素从左到右非金属性逐渐增强,则非金属性:乙大于甲,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性乙大于甲,故A错误;
B.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性甲比乙弱,故B正确;
C.元素的非金属性越强,对应的单质的氧化性越强,则离子的还原性越弱,故C错误;
D.同周期原子从左到右原子半径逐渐减小,若原子半径甲大于乙,则原子序数乙大于甲,根据同周期元素从左到右非金属性逐渐增强,可知非金属性乙大于甲,故D错误.
故选B.
本题解析:
本题难度:一般
2、选择题 人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一.氦的该种同位素应表示为( )
A.34He
B.23He
C.24He
D.33He
参考答案:由氦的质子数为2,质量数为3,故该种同位素应写为23He,则B项正确.
故选B.
本题解析:
本题难度:一般
3、选择题 下列对于乙烯(CH2=CH2)分子结构的描述中正确的是
A.有6个σ键、0个π键
B.3个sp3杂化轨道形成σ键、1个sp3杂化轨道形成π键
C.C-H之间是s轨道与sp2轨道形成的σ键,C与C之间是未参加杂化的2p轨道形成的σ键和π键
D.C与C之间是sp2杂化轨道形成的一个σ键和未参加杂化的2p轨道形成的π键
参考答案:D
本题解析:试题分析:单键都是σ键,双键或三键中含有π键,据此可知,乙烯分子中含有5个σ键、1个π键,A错误;乙烯是平面型结构,碳原子是sp2杂化,杂化轨道只能形成σ键,所以选项BC都是错误,D正确,答案选D。
考点:考查乙烯的分子结构特点
点评:该题是基础性试题的考查,主要是考查学生对乙烯分子结构的熟悉了解程度,特别是杂化轨道类型的掌握情况,有利于调动学生的学习兴趣,激发学生的学习积极性。
本题难度:一般
4、选择题 下列元素的最高价氧化物对应的水化合物酸性最强的是( )
A.Mg
B.S
C.Cl
D.Si
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列化学用语正确的是( )
A.中子数为8的碳原子:814C
B.C1一的结构示意图:
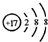
C.HClO的结构式:H-Cl-O
D.CO2的电子式:
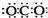
参考答案:A、8个中子的碳原子的核素符号为:614C,故A错误.
B、氯原子获得1个电子形成氯离子,Cl-离子的结构示意图为:
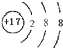
,故B正确.
C、根据稳定结构,氯元素成一个键,氧元素成两个键.HClO的结构式为:H-O-Cl,故C错误.
D、CO2中碳与氧之间为双键,CO2的电子式为:
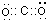
,故D错误.
故选:B
本题解析:
本题难度:简单