微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 4.35 g二氧化锰能与浓盐酸(密度为1.19 g·cm-3、质量分数为36.5%)完全反应。求:
(1)盐酸中HCl的物质的量浓度。
(2)被氧化的HCl的物质的量。
(3)将所得气体全部用石灰乳吸收,可得到漂白粉的质量。
参考答案:(1)11.9mol/L?(2)0.1mol? (3)6.35g? (每小题2分,共6分)
本题解析:(1)设浓盐酸的体积为1L,则c(HCl)=1000ml×1.19g/cm3×36.5%÷36.5g/mol÷1L=11.9mol?L?1。
(2)根据化学方程式:MnO2+4HCl(浓) MnCl2+ Cl2↑+2H2O MnO2与被氧化的HCl物质的量之比为1:2,? n(MnO2)=4.35g÷87g/mol=0.05mol,则被氧化的HCl为0.1mol。
MnCl2+ Cl2↑+2H2O MnO2与被氧化的HCl物质的量之比为1:2,? n(MnO2)=4.35g÷87g/mol=0.05mol,则被氧化的HCl为0.1mol。
(3)n(Cl2)=n(MnO2)=0.05mol,根据反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,则漂白粉的质量为:0.025mol×111g/mol+0.025mol×143g/mol=6.35g。
本题难度:一般
2、填空题 (6分)同温同压下,同体积的N2和SO2分子数之比为?,物质的量之比为?,原子总数之比为?,摩尔质量之比为?,质量之比为?,密度之比为?。
参考答案:(1)1:1(2)1:1 (3)2:3(4)7:16 (5) 7:16 (6)7:16
本题解析:考查物质的量的有关计算。
根据阿伏加德罗定律可知,同温同压下,同体积的N2和SO2分子数之比为1:1。所以根据 可知,物质的量之比为1:1;根据化学式可知,原子总数之比为1×2:1×3=2:3;二者的相对分子质量分别是28和64,所以摩尔质量之比为28︰64=7:16。由于物质的量相同,所以质量之比是7:16。在相同条件下,气体的密度之比是相应的摩尔质量之比,所以密度之比是7:16。
可知,物质的量之比为1:1;根据化学式可知,原子总数之比为1×2:1×3=2:3;二者的相对分子质量分别是28和64,所以摩尔质量之比为28︰64=7:16。由于物质的量相同,所以质量之比是7:16。在相同条件下,气体的密度之比是相应的摩尔质量之比,所以密度之比是7:16。
本题难度:一般
3、填空题 实验室要配制100mL?2mol/L?NaCl溶液,请回答下列问题
(1)制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和______.
(2)用托盘天平称取氯化钠固体,其质量为______?g.
(3)若定容时俯视容量瓶刻度线,会造成所配溶液的物质的量浓度______(偏大、偏小或无影响).
参考答案:(1)实验操作的步骤:计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,该实验中需要用天平称量、用药匙取药品,烧杯溶解药品,需要玻璃棒搅拌和引流,需要100mL容量瓶配制溶液,需要胶头滴管定容,
故答案为:100mL容量瓶;
(2)需要氯化钠的质量=2mol/L×0.1L×58.5g=11.7g,
故答案为:11.7;?
(3)定容时俯视容量瓶刻度线,液面在刻度线下方,溶液的体积偏小,结合c=nV可知,所配溶液的浓度偏大,
故答案为:偏大.
本题解析:
本题难度:一般
4、选择题 下列示意图中,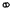 代表氢原子,
代表氢原子, 代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不记)。其中能表示等质量的氢气与氦气的是
代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不记)。其中能表示等质量的氢气与氦气的是
[? ]
A.
B.
C.
D.
参考答案:A
本题解析:
本题难度:一般
5、填空题 (本题共8分)右图是医院病人输液使用的一瓶质量分数为25%的葡萄糖(C6H12O6)注射液标签,请认真观察标签所列内容后填写:

(1)该葡萄糖注射液属于分散系中的?(从“溶液”、
“胶体”、“浊液”中选择)。
(2)葡萄糖的摩尔质量为?。
(3)已知该葡萄糖注射液的密度是1g/mL,其物质的量浓度为
?(列式计算)。
参考答案:
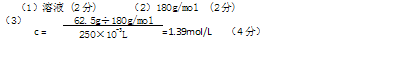
本题解析:略
本题难度:一般