微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤。
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤。
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬。
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀。
⑤______________________________。
⑥______________________________。
⑦蒸发、冷却结晶并从溶液中分离出晶体。
⑧用少量乙醇洗涤并凉干。
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:
______________________________。
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是:______________________________。
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH值2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去。下图是温度-pH值与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,
Fe(OH)3的Ksp=2.64×10-39)。下列说法正确的是______________(选填序号)。
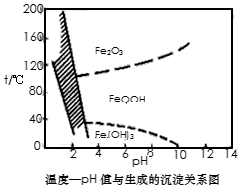
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为:6Fe2++ClO3-+6H+=6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是:_________________________。
(5)补充上述步骤⑤和⑥【可提供的试剂有6mol/L的H2SO4溶液,蒸馏水、pH试纸】。
⑤_________________________
⑥_________________________
2、填空题 海洋是个巨大的资源宝库,利用海水可制取许多化工产品。
(1)氯碱工业是以电解食盐水为基础化学工业,写出电解食盐水的化学方程式___________________________________________________________________.
(2)从海水中提取溴常用吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2)。流程示意图如下:
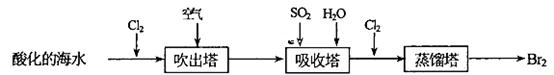
①写出氯气从NaBr中置换出溴单质的化学方程式:____________________;该反应在pH=3的酸性条件下进行,可用________测定反应液的酸碱度。
②吹出的溴和大量空气混合在—起进入吸收塔,根据流程图分析,通入SO2和水的目的是。_____________________________________________________.(用化学方程式表示)
3、填空题 除去括号中的杂质,写出所加试剂的化学式与反应的离子方程式。
(1)SO42-(CO32-),所加试剂__________,离子方程式________________________;
(2)Cl-(SO42-),所加试剂__________,离子方程式________________________;
(3)O2(CO2),所加试剂__________,离子方程式________________________;
(4)Fe2+(Cu2+),所加试剂__________,离子方程式________________________。
4、实验题 有A、B、C、D、E、F、G七瓶不同物质的溶液,它们各是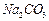 、
、 、
、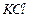 、
、 、
、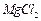 、
、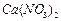 和
和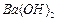 溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显现象。试回答下列问题。
溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显现象。试回答下列问题。
?
| A
| B
| C
| D
| E
| F
| G
|
A
| -
| -
| -
| -
| -
| -
| ↓
|
B
| -
| -
| -
| -
| ↓
| ↓
| ↓
|
C
| -
| -
| -
| ↓
| -
| ↓
| ↓
|
D
| -
| -
| ↓
| -
| ↓
| ↓
| ↓
|
E
| -
| ↓
| -
| ↓
| -
| ↓
| -
|
F
| -
| ↓
| ↓
| ↓
| ↓
| -
| ↓
|
G
| ↓
| ↓
| ↓
| ↓
| -
| ↓
| -
|
(1)A的电子式是 ,G的化学式是 。判断理由
是 。
(2)写出其余几种物质的化学式B ,C ,D 。
(3)①写出D与E反应的化学方程式 ;
②G与过量氨水总反应的离子方程式 。
5、选择题 过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液 ② 加入稍过量的NaOH溶液③ 加入稍过量的BaCl2溶液 ④滴入稀盐酸至无气泡产生 ⑤ 过滤 ,下列操作顺序不合理的是
[? ]
A.③②①⑤④
B.③①②⑤④
C.②③①⑤④
D.①③②④⑤