微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下面有关电化学的图示,完全正确的是
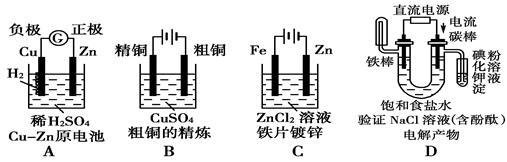
参考答案:D
本题解析:锌的金属性强于铜,锌是负极,铜是正极,A不正确;粗铜精练时,粗铜作阳极和电源的正极相连,B不正确;铁上镀锌时,铁是阴极,和电源的负极相连,C不正确,属于正确的答案选D。
本题难度:一般
2、选择题 下列有关钢铁腐蚀与防护的说法正确的是?
[? ]
A.?钢管与电源正极连接,钢管可被保护 ?
B.?铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 ?
C.?钢管与铜管露天堆放在一起时,钢管不易被腐蚀 ?
D.?钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+
参考答案:B
本题解析:
本题难度:一般
3、选择题 (10+6分)有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000 mL水,加入一定量的NaCl 固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm的细铁丝,将铁丝放入试管中,加入约? 10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如右下图。过一会儿:
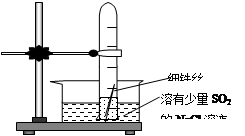
(1)观察到试管中的液面逐渐下降,这说明
在该条件下,铁丝发生了?腐蚀,
正极材料是?电极反应是?
(2)再过一段时间发现液面停止下降,并且开始逐渐
上升,露在液面上的铁丝表面由原来的银白色变棕褐色,这说明在该条件下,铁丝发生了
?腐蚀,正极的电极反应为?
①总反应为:?;①反应的产物极易被进一步氧化,生成红褐色物质,②该反应的化学方程式为:?若铁锈的组成为:Fe2O3·xH2O ,试写出由②反应的产物在通常条件下生成铁锈的反应方程式:
③?
附加题(6分)(3)已知原来铁丝质量为2 g,发生(1)情况时,依液面下降的高度折为标准状况下的体积是5.6mL,则此时,铁丝的质量变为?g ,随后液面开始上升,即发生(2)的变化,依最终液面上升的高度折算为标准状况下的体积比最开始刚倒扣于水槽中试管中溶液的体积多了1.12mL,通过计算,(2)的过程共消耗氧气?mL,若x值为2,那么铁丝的质量应为?g(以上计算有效数字保留至小数点后三位)
参考答案:(1)析氢,C或炭?2H++2e―→ H2↑?
(2)吸氧?O2+ 4e―+ 2H2O → 4OH―
①? 2Fe +O2+ 2H2O = 2Fe(OH)2?(每空1分共6分)
② 4Fe(OH)2+O2+ 2H2O = 4Fe(OH)3? ( 2分)
③ 2Fe(OH)3=Fe2O3·xH2O +(3-x)H2O?( 2分)
附加题(每空2分,共6分)
(3)1.986 铁被溶解的物质的量即为氢气的物质的量,0.00025mol 即0.014g,2-0.014=1.986
6.72?被吸收氧气的体积应为? 5.6+1.12=6.72 mL
2.003? 1.986+增加了氧的质量(0.0003×32)+增加水的质量(0.0004×18)=2.0028
本题解析:略
本题难度:一般
4、填空题 (8分)化学电源在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O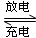 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是?(填序号)
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是?(填序号)
①以上反应不是可逆反应②电解质溶液为硫酸
③充电时化学能转变为电能?④镉(Cd)为负极,发生还原反应
⑤放电时正极区pH升高
(2)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源。氢氧燃料电池的突出优点是把化学能直接转化为电能,而不经过热能中间形成,发生的反应为: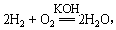 则负极反应式为___?_____________?_,正极反应式为?。一段时间后,KOH溶液的浓度?(填“变大”、“变小”或“不变”)
则负极反应式为___?_____________?_,正极反应式为?。一段时间后,KOH溶液的浓度?(填“变大”、“变小”或“不变”)
参考答案:(每空2分)(1)①⑤?(2)H2-2e–+2OH—=2H2O? O2+2H2O+ 4e– =4OH–?变小
本题解析:考查电化学的综合应用。
(1)应用放电和充电的反应条件不同,所以反应不是可逆反应,选项①正确;Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,所以电解质不能用硫酸,选项②不正确;充电相当于电解,电能转化为化学能,选项③不正确;放电是镉失去电子,发生氧化反应,作负极,选项④不正确;放电时正极电极反应式是2NiO(OH)-+2e-+2H2O=2OH-+2Ni(OH)2,所以放电时正极区pH升高,选项⑤正确,答案选①⑤。
(2)原电池负极失去电子,所以氢气在负极通入,电极反应式是H2-2e–+2OH—=2H2O;氧气在正极通入,电极反应式是O2+2H2O+ 4e– =4OH– 。由于反应中有水生成,所以氢氧化钾的浓度降低,pH变小。
本题难度:一般
5、选择题 下列有关钢铁腐蚀与防护的说法正确的是
[? ]
A.钢管与电源正极连接,钢管可被保护
B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀
C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀
D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+
参考答案:B
本题解析:
本题难度:一般