微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某主族元素的原子,核外有四个电子层,最外层有7个电子。下列关于此元素的说法中正确的是(?)
A.其单质的氧化性比Cl2强
B.其氢化物的稳定性比HCl强
C.其原子半径比氯的原子半径大
D.其简单阴离子的还原性比Cl-弱
参考答案:C
本题解析:根据元素的电子层结构可知,该元素位于第四周期第ⅦA,是溴元素。同主族自上而下原子半径逐渐增大,非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱,相应氢化物的稳定性逐渐减弱。非金属性越强,相应阴离子的还原性越弱,C正确,其余都是错误的,所以答案选C
本题难度:简单
2、填空题 元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
元素代号
| A
| B
| C
| D
| E
|
原子半径/nm
| 0.16
| 0.143
| 0.102
| 0.089
| 0.074
|
主要化合价
| +2
| +3
| +6,-2
| +2
| -2
|
?
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。
(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
参考答案:(1)
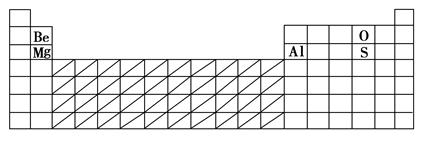
(2)见上表 (3)O2-
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)BeO+2OH-=BeO22-+H2O
本题解析:(1)根据表格提供数据,可以推断D为Be,A为Mg,E为O,C为S,B为Al。(2)根据元素周期律,在过渡元素区域寻找催化剂材料。(3)根据具有相同电子层结构的不同微粒,核电荷数越大,微粒半径越小,Mg2+、Al3+、O2-中半径最大的为O2-。(4)Al与Mg在化学性质上明显不同的是Al能与强碱溶液反应。
本题难度:简单
3、填空题 近期曝出的“毒大米”事件,引起了国人的震惊和忧虑,又一次把环境问题摆在了我们面前。“毒大米”是由镉污染引起的,会对人体健康造成严重危害。镉元素在元素周期表中的图示如图所示。

请回答下列问题:
(1)镉元素的原子序数为?,在元素周期表中的位置是?。
(2)有人说:“‘毒大米’中镉的含量很低,每人每天食用大米量也较少,所以,不会对人体健康造成严重危害。”你对这种说法有何评论??。
(3)你认为“毒大米”中镉的来源是什么??。
(4)镉也是生产电池的重要材料,镉镍二次电池(碱性)的放电和充电反应为:
Cd + 2NiO(OH) + 2H2O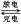 Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
电池的负极是?。
负极的电极反应式为?。
若负极消耗a g反应物,产生N个电子的电量,则阿伏加德罗常数NA=?。
参考答案:(9分)?(1)48(1分)?第五周期第ⅡB族(1分)
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害。(1分)
(3)工业生产造成了土壤的镉污染,富集在大米中(1分)
(4)Cd(镉)(1分)? Cd-2e—+2OH—=Cd(OH)2(2分)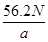 mol—1(2分)
mol—1(2分)
本题解析:(1)镉元素在元素周期表中的图示可知,镉元素的原子序数为48,在元素周期表中的位置是第五周期第ⅡB族。
(2)长期食用“毒大米”会使镉在人体内累积增多,最终仍然会对人体健康造成严重危害,所以这种说法是错误的。
(3)“毒大米”中镉的来源是工业生产造成了土壤的镉污染,富集在大米中。
(4)放电相当于是原电池,原电池中负极失去电子,化合价升高,发生氧化反应。所以根据化学方程式可知,该电池的负极是Cd,负极电极反应式是Cd-2e—+2OH—=Cd(OH)2。agCd的物质的量是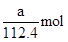 ,在反应中失去
,在反应中失去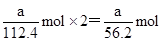 电子,所以阿伏加德罗常数NA=
电子,所以阿伏加德罗常数NA=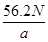 mol—1。
mol—1。
点评:该题以近期曝出的“毒大米”事件为载体,重点考查学生对元素周期表结构、原电池原理以及灵活运用基础知识解决实际问题的能力的培养,有利于调动学生的学习兴趣,激发学生的学习积极性。也有助于培养学生的环境保护意识,增强学生的社会责任感。
本题难度:一般
4、填空题 碳及其化合物应用广泛。
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图__________。
(2)向1L恒容密闭容器中注人CO和H2o(g),830℃时测得部分数据如下表。则该温度下反应的平衡常
数K=______________。

(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
II.已知CO(g)+1/2 O2 (g)=CO2 (g)?△H=一141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g)?△H=一484 kJ·mol-1
CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g)?△Hl=一726 kJ·mol-1
(4)利用CO、H2化合制得液态甲醇的热化学方程式为___________。
III.一种新型氢氧燃料电池工作原理如下图所示

(5)写出电极A的电极反应式_____________。
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通人O2的体积为_____L(标准状况)。
参考答案:(1) (2分)
(2分)
(2)1 (3分)
(3)< (2分)
(4)CO(g) + 2H2(g)=CH3OH(l)?△H=+101 kJ/mol?(方程式对给1分,共3分)
(5)H2-2e-+ CO32- =CO2 + H2O (3分)?(6)2.24 (2分)
本题解析:(1)硅因素位于第三周期第ⅣA族,因此原子结构示意图为 。
。
(2)根据表中数据可知,平衡时CO和水蒸气的浓度分别是0.080mol/L和0.180mol/L,其中消耗CO的浓度是0.200mol/L-0.080mol/L=0.120mol/L,因此根据方程式可知生成CO2和氢气的浓度均是0.120mol/L,实验该温度下反应的平衡常数K= =1。
=1。
(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,则此时 =4>1,所以反应逆反应方向进行,因此v(正 )<v(逆)。
=4>1,所以反应逆反应方向进行,因此v(正 )<v(逆)。
(4)已知① CO(g)+1/2 O2 (g)=CO2 (g)?△H=一141 kJ·mol-1、② 2H2(g)+ O2(g)=2H2O(g)?△H=一484 kJ·mol-1、③ CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g)?△Hl=一726 kJ·mol-1,则根据盖斯定律可知①+②-③即得到CO、H2化合制得液态甲醇的热化学方程式为CO(g) + 2H2(g)=CH3OH(l)?△H=+101 kJ/mol。
(5)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应。则根据装置图可知,氢气在A电极通入,因此A电极是负极,由于电解质是熔融的碳酸钾,而原电池中阴离子向负极移动,所以负极电极反应式为H2-2e-+ CO32- =CO2 + H2O。
(6)电解池中氯离子放电生成氯气,电极反应式为2Cl-2e-=Cl2↑,所以生成0.2mol氯气转移电子的物质的量是0.4mol。氧气在反应中得到4个电子,因此根据得失电子守恒可知消耗氧气的物质的量是0.4mol÷4=0.1mol,在标准状况下的体积是2.24L。
本题难度:困难
5、选择题 某短周期元素原子最外层只有2个电子,则该元素(?)
A.一定是第ⅡA族元素
B.一定是金属元素
C.一定是化合物中呈+2价元素
D.可能是金属元素,也可能是非金属元素
参考答案:D
本题解析:元素原子最外层只有2个电子,若为主族元素则在周期表中处于第ⅡA族,为金属元素,在化合物中呈+2价,若为He,则为0族元素。
本题难度:一般