微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向CaCl2、MgBr2、KI的混合溶液中通入Cl2后,若溶液中含有Br2,则一定不会含有(? )
A.I-
B.Cl2
C.Br-
D.Cl-
参考答案:A
本题解析:本题考查卤素单质氧化性的强弱知识。卤素单质的氧化性强弱顺序Cl2>Br2>I2,氧化性强的单质可将氧化性弱的单质从其盐溶液中置换出来,如Br2+2I-====I2+2Br-。所以当溶液中含有Br2时,一定不会含有I-。
本题难度:简单
2、选择题 下列说法不正确的是( )
①在NaOH的酚酞稀溶液中不断通入氯气,溶液颜色呈现出红→无→浅黄绿的变化;
②氯水具有漂白性,在紫色的KMnO4溶液中滴加氯水最终会得到无色溶液;
③液氯可储存于钢瓶,它能使干燥的有色布条褪色;
④氯气有毒,实验室里往往用石灰水溶液来吸收过量的Cl2;
⑤把氯气通到NaBr溶液中,并不会发生任何化学反应.
A.②③④⑤
B.①③⑤
C.②④
D.全部错误
参考答案:①碱遇酚酞变红,氯气通入溶液中生成 的HClO具有漂白性,最后得到氯水与NaCl的混合物,氯水为浅黄绿色,则在NaOH的酚酞稀溶液中不断通入氯气,溶液颜色呈现出红→无→浅黄绿的变化,故①正确;
②氯气与高锰酸钾不发生反应,则氯水不能使高锰酸钾褪色,故②错误;
③干燥的氯气不具有漂白性,所以液氯可储存于钢瓶,它不能使干燥的有色布条褪色,故③错误;
④相同条件下,NaOH的溶解度比氢氧化钙大,所以实验室里往往用NaOH溶液来吸收过量的Cl2,故④错误;
⑤氯气的氧化性大于溴,则氯气通到NaBr溶液中,氯气与NaBr溶液发生氧化还原反应生成氯化钠和溴,故⑤错误;
故选A.
本题解析:
本题难度:简单
3、选择题 向含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是(?)
A.KCl
B.NaCl和KCl
C.NaCl和KBr
D.NaCl、KCl和I2
参考答案:B
本题解析:通入过量Cl2,发生反应2NaBr+Cl2====2NaCl+Br2,2KI+Cl2====2KCl+I2,蒸干灼烧时Br2挥发,I2升华。
本题难度:简单
4、选择题 下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述I | 叙述Ⅱ
A
氯气具有强还原性
可用于自来水的消毒杀菌
B
SiO2导电能力强
可用于制造通讯光缆
C
常温下铝在浓硫酸中钝化
常温下可用铝制容器盛放浓硫酸
D
Na2S还原性强
用于除去废水中的Cu2+和Hg2+
|
A.A
B.B
C.C
D.D
参考答案:A.氯气具有强氧化性,用于杀菌消毒,与还原性无关,因果关系不成立,故A错误;
B.二氧化硅具有良好的导光性,则用于制造通讯光缆,因果关系不成立,故B错误;
C.常温下铝在浓硫酸中钝化,生成致密的氧化物,阻止反应的进一步发生,所以常温下可用铝制容器盛放浓硫酸,故C正确;
D.用Na2S除去废水中的Cu2+和Hg2+,发生复分解反应生成沉淀,与还原性无关,因果关系不成立,故D错误;
故选C.
本题解析:
本题难度:简单
5、简答题 (1)某学习小组利用下图装置制取氯气并探究其性质.
①甲装置中反应的化学方程式是______;
②证明乙装置中FeCl2溶液与Cl2发生了反应的实验方法是(只注明试剂、现象)______;
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质.已知碳酸的酸性强于次氯酸,则丙中反应的化学方程式是______.
(2)有一瓶长期放置的漂白粉,请利用以下仪器和试剂,完成该漂白粉成份的探究.
试管、胶头滴管、带导管的单孔塞、蒸馏水、1mol?L-1盐酸、品红溶液、新制澄清石灰水.
【提出假设】假设一:该漂白粉未变质,含CaCl2、Ca(ClO)2;
假设二:该漂白粉全部变质,含______;
假设三:该漂白粉部分变质,含CaCl2、Ca(ClO)2、CaCO3.
【进行实验】在答题卡上完成下表(不必检验Ca2+、Cl-):
| 实验步骤 | 预期现象和结论
①
用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管______
若无气体放出且澄清石灰水未见浑浊,则假设一成立;______
②
______
______
|
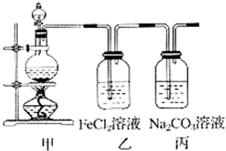
参考答案:(1)①浓盐酸和二氧化锰在加热条件下能发生氧化还原反应生成氯化锰、氯气、水,反应的化学方程式为MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O;
②氯化铁和氯气反应,2FeCl2+Cl2=2FeCl3,三价铁离子和硫氰酸钾反应生成血红色溶液,Fe3++3SCN-=Fe(SCN)3,故答案为:KSCN,溶液变为血红色;
③氯气和水反应生成盐酸和次氯酸,盐酸和足量碳酸钠反应生成氯化钠和碳酸氢钠,次氯酸和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以方程式为Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3,故答案为:Cl2+2Na2CO3+H2O=NaCl+NaClO+2NaHCO3.
(2)漂白粉的主要成分为CaCl2、Ca(ClO)2,Ca(ClO)2易与空气中二氧化碳和水反应生成HClO,HClO不稳定,见光分解生成HCl和水,最终生成CaCl2、CaCO3;
如漂白粉没有变质,则漂白粉中无CaCO3,加入盐酸后无气体放出且澄清石灰水未见浑浊;
如漂白粉全部变质,则产物为CaCl2、CaCO3,取少量样品于试管中,加入足量的稀盐酸,并将所得气体依次通入品红溶液和澄清石灰水,则品红不褪色,而石灰水变浑浊;
如漂白粉部分变质,漂白粉中含有CaCl2、Ca(ClO)2、CaCO3,取少量样品于试管中,加入足量的稀盐酸,并将所得气体依次通入品红溶液和澄清石灰水,品红溶液褪色,澄清石灰水变浑浊,
故答案为:CaCl2、CaCO3;
实验步骤预期现象和结论①再向B试管加入1mol/L的稀盐酸加入适量1mol/L的盐酸,塞上带导管的单孔塞,将导管的另一端插入A试管中若有气泡冒出,且澄清石灰水变浑浊则假设一步成立,假设二、三成立②用胶头滴管向上述步骤后的B试管中滴入几滴品红试液,振荡若品红溶液不褪色,则假设二成立,若品红溶液褪色,则假设三成立
本题解析:
本题难度:一般