| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《热化学方程式》高频试题强化练习(2017年最新版)(十)
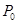 ,则反应达到平衡时苯乙烯的浓度为 , (均用含 ,则反应达到平衡时苯乙烯的浓度为 , (均用含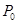 、P的表达式表示)。 、P的表达式表示)。(4)写出由苯乙烯在一定条件下合成聚苯乙烯的化学方程式 。 参考答案:(1)+158.8kJ·mol-1(2分)(2)①是(2分) ②abd (3分) ③d(2分) 本题解析:(1)根据盖斯定律,两个方程式合并就得到乙苯制取苯乙烯反应的 本题难度:困难 5、选择题 下列热化学方程式中的ΔH能表示物质燃烧热的是( ) |
参考答案:B
本题解析:
【错解分析】“生成稳定的氧化物”的两层涵义:①指燃烧产物不能再燃烧(如生成CO2、H2O、SO2、N2等);②是生成物的聚集状态在燃烧热测定条件下处于稳定状态,一般燃烧热常用298K时数据,如H2的燃烧热是指1mol氢气完全燃烧生成液态水时放出的热量。
燃烧热的计算标准是以可燃物为1mol来进行测量和计算的,因此在计算燃烧热时,热化学方程式里的化学计量数常常出现分数。
【正解】“燃烧热”的定义是:在101 kPa时,1 mol物质完全燃烧生成稳定的氧化物时放出的能量;热化学方程式中的化学计量数表示物质的量。A、C项中CO、H2的物质的量是2 mol,不行;D项H2不是在氧气中燃烧,不符合燃烧热的定义。
本题难度:简单
|
||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | ||
| 下一篇:高考化学知识点总结《氯及其化合.. | ||