微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验装置是探究铜丝与过量浓硫酸的反应,下列叙述正确的是 (?)

A.上下移动①中铜丝可控制SO2的量
B.②中品红溶液不褪色
C.③中石蕊溶液变蓝色
D.为确认CuSO4生成,向①中加水,观察溶液颜色
参考答案:A
本题解析:在加热的条件下,当铜丝与浓硫酸接触时才能反应,当往上抽动铜丝时,铜丝与硫酸不接触,反应停止,故可通过上下移动①中铜丝可控制SO2的量,故A正确;SO2具有漂白性,品红能被二氧化硫漂白,可用品红溶液验证SO2的生成,故B不正确;SO2为酸性气体,溶于水显酸性,能使石蕊溶液变红色,故C不正确;铜与浓硫酸的反应Cu+2H2SO4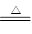 ?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
?CuSO4+SO2↑+2H2O,实验中,铜丝与过量浓硫酸的反应生成是硫酸铜,试管中含有大量水,不会生成白色固体,CuSO4溶液呈蓝色,为确认CuS04生成,无须向①中加水,故D错误,答案选A。
点评:该题是中等难度的试题,试题基础性强,紧扣教材,意在巩固学生的基础,提高学生的实验分析和探究能力,有利于培养学生的学习兴趣,激发学生的学习积极性。答题时注意二氧化硫的酸性和漂白性。
本题难度:简单
2、选择题 验证乙酸乙酯密度,溶解性和水解三项性质的合理实验是(?)
A.将其滴入水中,随即滴加碱液并迅速加热至沸腾
B.将其滴入沸腾的碱液中观察
C.将其滴入水中观察片刻,再滴加含有酚酞的碱液并缓缓加热
D.将其滴入沸腾的水中观察
参考答案:C
本题解析:滴入水中后观察,可以判断其密度和溶解性,加碱液,不再分层,可以判断水解。
本题难度:一般
3、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
选项
| 实验操作
| 实验目的或结论
|
A
| 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体
| 说明该钾盐是K2CO3
|
B
| 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一段时间后过滤
| 除去MgCl2溶液中少量FeCl3
|
C
| 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生
| 说明常温下K sp(BaCO3)<K sp(BaSO3)
|
D
| C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液
| 检验制得的气体是否为乙烯
参考答案:B
本题解析:略
本题难度:一般
4、选择题 能够用来鉴别BaCl2、KOH、Na2CO3三种物质的试剂是( )
A.AgNO3溶液
B.稀硫酸
C.稀盐酸
D.稀硝酸
参考答案:A.BaCl2、Na2CO3均与AgNO3溶液反应生成白色沉淀,现象相同,不能鉴别,故A错误;
B.BaCl2、KOH、Na2CO3三种物质分别与稀硫酸反应的现象为:白色沉淀、无现象、生成无色气体,现象不同,可鉴别,故B正确;
C.BaCl2、KOH与稀盐酸混合,现象相同,不能鉴别,故C错误;
D.BaCl2、KOH与稀硝酸混合,现象相同,不能鉴别,故D错误;
故选B.
本题解析:
本题难度:一般
5、简答题 硫化钠和碳酸钠为原料、采用下述装置制备硫代硫酸钠,制备反应可表示为:
2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2.根据要求回答问题:
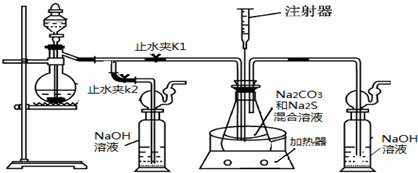
(1)实验时,打开K1,关闭K2,最后洗气瓶中发生反应的离子方程式是______.
(2)锥形瓶内溶液pH小于7时会导致产品分解,因此实验过程中需要控制锥形瓶内溶液的pH.
①反应过程中,锥形瓶中溶液pH将______(填“增大”、“减小”或“保持不变”).
②测量锥形瓶中溶液pH时,用注射器吸取溶液样品比直接打开锥形瓶中瓶塞取样,除操作简便外,还具有的优点是______.
③若实验过程中测得溶液pH已接近于7.此时应该进行的操作是______.
(3)已知:2Na2?S2O3+I2=2NaI+Na2?S4O6.实验结束后进行相关处理,可即获得Na2?S2O3?5H2O晶体.为测量其纯度,取晶体样品mg,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是______
(4)制取硫代硫酸钠的另一种方法是直接将硫粉和亚硫酸钠、水混合共热制取.为探究制取硫代硫酸钠最佳条件(溶液pH、亚硫酸钠浓度、反应温度、硫粉质量),设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
实验序号
溶液pH
亚硫酸钠与水的质量比
反应温度
硫粉质量
亚硫酸钠转化率
1
10
1.5:1
100
18
80.7%
2
a
1.1:1
100
18
94.6%
|
①实验1、2的目的是探究亚硫酸钠浓度对亚硫酸钠转化率的影响,则a=______
②若还要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,除实验1、2外,至少还需进行______次对比实验.
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.为什么?答:______.
参考答案:(1)打开K1,关闭K2,进入最后洗气瓶的尾气含有CO2、SO2.二氧化碳与氢氧化钠反应生成碳酸钠与水,二氧化硫与氢氧化钠反应生成亚硫酸钠与水.反应离子方程式为CO2+2OH-=CO32-+H2O、SO2+2OH-=SO32-+H2O,
故答案为:CO2+2OH-=CO32-+H2O、SO2+2OH-=SO32-+H2O.
(2)①随反应进行,Na2S、Na2CO3浓度降低,同时生成二氧化碳,所以锥形瓶中溶液碱性减弱,pH将减小,故答案为:减小;
②直接打开锥形瓶中瓶塞取样,二氧化硫会逸出,污染空气.故用注射器吸取溶液样品除操作简便外,还具有的优点是防止二氧化硫污染空气,
故答案为:防止二氧化硫污染空气;
③锥形瓶内溶液pH小于7时会导致产品分解,当溶液pH已接近于7,应停止实验,用左边的洗气瓶吸收二氧化硫,防止污染空气,故应关闭K1,打开K2,
故答案为:关闭K1,打开K2;
(3)vmL0.010mol/L碘水溶液中n(I2)=v×10-3L×0.010mol/L=v×10-5mol,则:
2Na2?S2O3~~~~~~~I2
? 2? 1
n(Na2?S2O3)? v×10-5mol
所以n(Na2?S2O3)=2×v×10-5mol=2v×10-5mol
Na2?S2O3?5H2O晶体的质量为2v×10-5mol×248g/mol=496v×10-5g.
则该样品纯度为496v×10-5gmg×100%=0.496vm%,
故答案为:0.496vm%;
(4)①探究亚硫酸钠浓度对亚硫酸钠转化率的影响,亚硫酸钠浓度浓度不同,其它条件应该相同,所以1、2两组实验,溶液的pH值相同,故a=10,
故答案为:10;
②要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,其它条件应相同情况下,应进行溶液pH不同对比实验、反应温度不同对比实验、硫粉质量不同对比实验,除实验1、2外,至少还需进行3次对比实验,故答案为:3;
③硫为固体,不影响平衡的移动,故答案为:硫为固体,不影响平衡的移动.
本题解析:
本题难度:一般