微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)在CH4、H2S、NH4+、H2O、OH—、HCl、Na、Mg2+八种粒子中,选择符合下列要求的粒子填空:
①上述粒子中与K+质子数不同,电子数相同的有??;
②上述粒子中与NH3质子数相同,电子数也相同的有?;
③上述粒子中电子数大于质子数的有??。
(2)用锌片、铜片和稀硫酸组成的原电池,该电池的负极材料是?,正极的电极反应式为?,电池工作时电子流向?(填“正极”或“负极”)。
(3)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为?;
②A的平均反应速率为?;
③5min时B的转化率为?。
参考答案:(13分)(1) ①H2S、HCl? (1分)?②CH4、H2O? (1分)?③OH—? (1分)
(2) 锌片? (1分)? 2H++2e—=H2↑ (2分)?正极? (1分)
(3)① 1? (2分)?②0.3mol?L-1?min -1(2分)?③50%? (2分)
本题解析:(1)①K+质子数于电子数分别是19和13,则与K+质子数不同,电子数相同的有H2S、HCl。
②氨气含有10个质子和10个电子,则与NH3质子数相同,电子数也相同的有CH4、H2O.
③电子数大于质子数,说明带负电荷,则是OH-。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,据此可知,该电池的负极材料是锌片,铜是正极,溶液中的氢离子得到电子,则正极的电极反应式为2H++2e—=H2↑,电池工作时电子流向正极。
(3)①经5min后反应达到平衡状态,容器内的压强变小,这说明该反应是体积减小的可逆反应,即3+1>x+2,所以x只能是1;
②D的平均反应速率为0.2mol/(L?min),则根据反应速率之比是相应的化学计量数之比可知,A的平均反应速率是0.3mol/(L?min)。
③生成D的物质的量是0.2mol/(L?min)×5min×2L=2mol,所以消耗B的物质的量是1mol,则B的转化率是50%。
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固和训练,旨在培养学生灵活运用基础知识解决实际问题的能力,难度不大,有利于培养学生的规范答题能力,提高学生的应试能力。
本题难度:一般
2、选择题 甲、乙、丙、丁4中物质分别含2种或3种元素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离出两种阴离子。下列推断合理的是

A.某拿酸溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应

B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键

C.丙中含有2周期IVA族的元素,则丙一定是甲烷的同系物

D.丁和甲中各元素质量比相同,则丁中一定含有-1价的元素
参考答案:D
本题解析:本题考查物质结构知识。选项A,甲是18电子的氢化物,且其水溶液为二元弱酸,不难得出甲为H2S,其中NaHS溶液中含有HS―、S2―,但NaHS能与盐酸等反应生成H2S。选项B,O2的摩尔质量为32g/mol,乙的摩尔质量也为32g/mol,且含有18电子,如CH3OH符合,CH3OH中只含有极性键无非极性键。选项C,第2周期ⅣA族元素为C,如CH3OH符合,但CH3OH不是CH4的同系物。选项D,H2S中元素的质量比为1/16(H/S),H2O2分子中元素的质量比也为1/16(H/O),H2O2中氧元素的价态为-1价,符合。
本题难度:一般
3、选择题 已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
A.与镓同主族且相邻周期的元素,其原子序数为23或49
B.与镓同周期且相邻主族的元素,其原子序数为30或32
C.原子半径:Br>Ga> Cl> Al
D.碱性:KOH>Ga(OH)3>Al(OH)3
参考答案:D
本题解析:A、镓(31Ga)是第四周期第ⅢA族元素,与镓同主族且相邻周期的元素,原子序数相差18,故为13或49,故A错误;B、镓(31Ga)是第四周期第ⅢA族元素,同周期ⅣA与之相邻,原子序数为32,与第ⅡA不相邻,故B错误;C、同周期自左而右原子半径逐渐减小,故原子半径Ga>Br、Al>Cl,故C错误;D、同周期自左而右金属性逐渐减弱,同主族自上而下金属性逐渐增强,故金属性K>Ga>Al。金属性越强最高价氧化物对应水化物的碱性越强,故碱性KOH>Ga(OH)3>Al(OH)3,故D正确,答案选D。
本题难度:一般
4、选择题 短周期主族元素A、B、C、D的原子序数依次增大,A和B形成的气态化合物的水溶液呈碱性,B位于第VA族,A和C同主族,D原子最外层电子数与电子层数相等。下列叙述正确的是
A.原子半径:D>C>B?
B.单质的还原性:D>C
C.元素A、B、C的氧化物均为非金属氧化物?
D.元素B、C、D的最高价氧化物对应的水化物能相互反应
参考答案:D
本题解析:A和B形成的气态化合物的水溶液呈碱性,则A是H,B是N。A和C同主族,所以C是Na。D原子最外层电子数与电子层数相等,则D是Al。A不正确,应该是C>D>B。同周期自左向右金属性逐渐减弱,B不正确。C不正确,氧化钠是金属氧化物,C不正确。氢氧化铝是两性氢氧化物,能和硝酸及氢氧化钠反应,D正确,答案选D。
本题难度:简单
5、填空题 根据题意回答下列问题
①Fe2+的电子排布式为?②基态铜原子简化电子排布式为?
③Se价电子排布图为?④第二周期第一电离能由小到大的次序为?
⑤铬原子的原子结构示意图为?
参考答案:①1s22s22p63s23p63d6 ②[Ar]3d104s1
③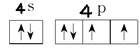 ? ④Li B Be C O N F Ne ⑤
? ④Li B Be C O N F Ne ⑤
本题解析:①根据构造原理可写出电子的排布式为1s22s22p63s23p63d6
②因为全充满或半充满是稳定的,所以基态铜原子简化电子排布式为[Ar]3d104s1
③根据泡利原理、洪特规则和能量最低原理可知,Se价电子排布图为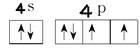
④非金属性越强,第一电离能越大,但由于和Be和N属于全充满或半充满状态,稳定性强,所以第二周期第一电离能由小到大的次序为Li B Be C O N F Ne。
⑤铬原子属于第四周期第ⅤB,原子结构示意图为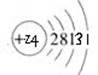 。
。
本题难度:一般