微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 比较下列碱的碱性强弱:? NaOH?KOH ?比较下列酸的酸性强弱:? H2SO4??HClO4?比较下列气态氢化物的稳定性:H2O?NH3
参考答案:﹤;﹤;>
本题解析:同主族,由上到下,原子的失电子能力逐渐增强,则最高价氧化物对应水化物的碱性增强,故NaOH﹤KOH;
同周期,由左到右,原子的得电子能力逐渐增强,则最高价氧化物对应水化物的酸性增强,故H2SO4﹤HClO4;
同周期,由左到右,原子的得电子能力逐渐增强,则气态氢化物的稳定性增强,故H2O>NH3;
本题难度:一般
2、选择题 下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族的元素的氢化物,相对分子质量越大,它的沸点不一定越高
D.目前使用的元素周期表中,最长的周期含有36种元素
参考答案:C
本题解析:同一主族元素,原子半径越大,金属单质的熔点逐渐降低,非金属单质的熔点逐渐升高,A错误;同一周期元素的原子,从左到右半径逐渐减小,,原子核对电子的吸引能力增强,得到电子的能力逐渐增强,失去电子的能力逐渐减弱,B错误;同一主族的元素的氢化物,由于可能存在氢建,所以相对分子质量越大,沸点不一定越高,如,H2O的沸点大于H2S,C正确;目前使用的元素周期表中,最长的周期含有32种元素,D错误。
本题难度:一般
3、填空题 A、B、C、D、E五种元素在周期表里的位置如下表所示:
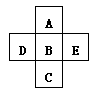
A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。
C元素名称是 ,D的最高价氧化物对应水化物的化学式 ,实验室制取单质E的化学方程式 ?。
参考答案:硒?磷酸? MnO2+4HCl(浓)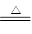 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
本题解析:根据周期表的结构可知,五种元素位于周期表的右侧,分别是第二、第三和第四周期。E为该周期中原子半径最小的元素,所以E是Cl,则B是S,D是P,A是O,C是Se。实验式制取氯气的化学方程式为MnO2+4HCl(浓)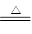 MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。
本题难度:简单
4、选择题 下列说法正确的是(?)
A.阴极射线、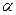 -粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献
-粒子散射现象及布朗运动的发现都对原子结构模型的建立作出了贡献
B.纤维素、PLA、纤维二糖、甲壳素、硝化纤维等都是高分子化合物
C.高容量储氢材料的研制是推广应用氢氧燃料电池的关键问题之一
D.硫、白磷、臭氧、碳-60、氩、水等物质固态时都是分子晶体,分子内都存在共价键
参考答案:C
本题解析:略
本题难度:简单
5、选择题 1863年提出原子学说,为近代化学发展奠定了坚实基础的化学家是(?)
A.英国的道尔顿
B.法国的拉瓦锡
C.俄国的门捷列夫
D.英国的汤姆生
参考答案:A
本题解析:A、正确;B、法国的拉瓦锡提出了以氧气为中心的燃烧学说,错误;C、俄国的门捷列夫提出了元素周期表,错误;D、英国的汤姆生发现了电子,错误。
本题难度:简单