微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从原子序数11依次增加到17,下列所述递变关系中,错误的是( )
A.电子层数逐渐增多
B.原子半径逐渐减小
C.最高正化合价数值逐渐增大
D.从硅到氯,最低负化合价从-4到-1
参考答案:A.原子序数11到17的元素在周期表同一周期,电子层数相等,故A错误;
B.同周期元素从左到右原子半径逐渐减小,故B正确;
C.原子序数11到17的元素在周期表同一周期,自左到右元素的最高化合价依次增大,故C正确;
D.从硅到氯,最低负化合价依次为-4、-3、-2、-1,故D正确.
故选A.
本题解析:
本题难度:简单
2、选择题 根据元素周期表和元素周期律分析下面的推断,其中正确的是( )
A.钾与水反应较钠与水反应更为剧烈
B.硒(Se)化氢比硫化氢稳定
C.氢氧化镁的碱性比氢氧化钡的碱性强
D.N、O、F原子半径依次增大
参考答案:A.钾比水钠活泼,则钾与水反应较钠与水反应更为剧烈,故A正确;
B.Se比S的非金属性弱,则硫化氢比硒化氢稳定,故B错误;
C.Ba的金属性比Mg强,则氢氧化钡的碱性比氢氧化镁强,故C错误;
D.同周期元素从左到右原子半径逐渐减小,故D错误.
故选A.
本题解析:
本题难度:一般
3、填空题 (一)下列是A、B、C、D、E五种短周期元素的某些些性质
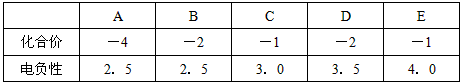
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3杂化方式的是________________
A.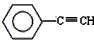
B.CH4
C.CH2=CHCH3
D.CH3CH2C≡CH
E.CH3CH3
(2)与AD2互为等电子体的分子、离子的化学式依次为_______________、_______________(各写1种)
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是_______________(写分子式),理由是 _______________;
(二)下列是部分金属元素的电离能
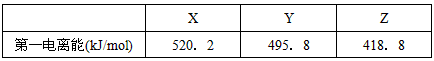
(4)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为
_______________。
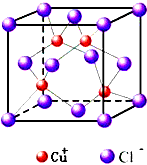
(5)CuCl用作有机机合成催化剂,并用于颜料,防腐等工业。CuCl的晶体结构如图所示。元素Cu基态原子的电子排布式_______________,与同一个Cl-相连的Cu+有_______________个。
参考答案:(1)D
(2)N2O;SCN-
(3)SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大
(4)ZCl<YCl<XCl
(5)“略”
本题解析:
本题难度:困难
4、简答题 科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部位于元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成.现有a~g?7种短周期元素,是除氧、硫、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
| a | ? | ? | ? | ?
?
? | ? | ?
?
d
e
?
?
?
b
c
?
?
f
?
g
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
?
|
(1)元素的原子间反应最容易形成离子键的是下列中的______,元素的原子间反应容易形成共价键的是下列中的______A.c和f?B.b和g?C.d和g?D.d和e
(2)下列由a~g形成的各分子中,所有原子都满足最外层为8电子结构的是______.
A.ea3?B.ag?C.fg3?D.dg4
(3)由11种元素的几种非金属元素构成的离子化合物的电子式为______.
(4)c与e可形成一种化合物,试根据原子结构写出该化合物的化学式______,化学键类型为______,与稀盐酸反应的方程式为______.
参考答案:(1)由对应周期表中位置知:a为H,b为Na,c为Mg,d为C,e为N,f为P,g为Cl,8种元素中最活泼的金属钠与最活泼的非金属Cl之间是容易形成离子键,非金属元素间一般形成共价键,故答案为:B;C;
(2)各选项对应的分子分别为NH3、HCl、PCl3、CCl4,其中NH3、HCl中由于氢形成的是2电子稳定结构,故不符合题意.而PCl3中,磷原子核外最外层电子数为5,它与氯原子形成共价键时,构成PCl3中的磷原子、氯原子最外层都达到8电子结构.同理,CCl4亦符合题意,故选C、D;
(3)氯化铵是几种非金属元素构成的离子化合物,电子式为:
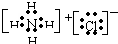
,故答案为:
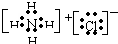
;
(4)根据化合价以及化合价原则,氮元素和镁元素之间形成的是Mg3N2,是含有离子键的离子化合物,可以和盐酸反应生成氯化镁和氯化铵,故答案为:Mg3N2;离子键;Mg3N2+8HCl=3MgCl2+2NH4Cl.
本题解析:
本题难度:一般
5、选择题 下列有关现在的长式元素周期表的叙述中,正确的是
[? ]
A.从左向右数第7纵行是ⅦA族
B.从左向右数第11纵行是1B族
C.IA族的全部元素都是金属元素
D.ⅦA族的全部元素只能表现出非金属元素的性质
参考答案:B
本题解析:
本题难度:简单