微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)取100mL FeCl3、AlCl3的混合溶液,逐滴加入物质的量浓度为1 mol·L-1的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积(单位为mL)关系如下图所示。
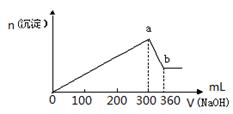
按要求回答:
(1)a点对应沉淀的物质的量是?mol;此时溶液中的溶质是?。
(2)b点对应沉淀的物质的量是?mol;原溶液中c(AlCl3)=?mol·L-1。
参考答案:(8分,每空2分)
(1) 0.1;? NaCl,?
(2) 0.04; 0.6
本题解析:(1)a点对应沉淀是沉淀的最大量,根据元素守恒,氢氧化铁和氢氧化铝沉淀中氢氧根离子是沉淀物质的量的3倍,所以沉淀的物质的量是氢氧化钠物质的量的1/3,300mL的氢氧化钠的物质的量是0.3mol,所以a点对应沉淀的物质的量是0.1mol,此时溶液中的溶质是NaCl;
(2)b点对应沉淀是氢氧化铁沉淀,氢氧化铝沉淀与60mL的氢氧化钠溶液反应,根据Al(OH)3~OH-,判断氢氧化铝沉淀的物质的量是0.06L×1 mol·L-1=0.06mol,所以b点对应沉淀的物质的量是0.1mol-0.06mol=0.04mol;根据铝元素守恒,原溶液中n(AlCl3)=0.06mol,则c(AlCl3)=0.06mol/0.1L=0.6mol/L.。
本题难度:一般
2、计算题 将一块表面已被氧化成氧化钠的钠块投入水中,完全反应后收集到气体224mL(标准状况),得到100mL溶液,向上述溶液中逐滴滴加1mol?L-1的稀盐酸30mL恰好完全中和。(1)写出钠与水发生反应的离子方程式,并标出电子转移的方向和数目。(2)计算所得NaOH溶液的物质的量浓度。(3)求钠块中氧化钠的质量分数。(请写出计算过程。)
参考答案:(每问各2分)(1)2Na?+ 2H2O ="=" 2 Na++2OH-+H2↑(电子转移省略)
(2)0.3mol/L?(3)40%
本题解析:略
本题难度:简单
3、选择题 4.6g钠在干燥的空气中被氧化后,得到7.8g固体,由此可判断其氧化产物为 (? )
A.只有Na2O2
B.只有Na2O
C.Na2O和Na2O2
D.无法确定
参考答案:A
本题解析: 解析:用极端假设法,当钠全部转化为Na2O时,质量为6.2g,当钠全部转化为Na2O2时,质量为7.8g,产物质量在6.2g和7.8g之间时,两种产物都有,实际产物质量是7.8个,所以是Na2O2。
解析:用极端假设法,当钠全部转化为Na2O时,质量为6.2g,当钠全部转化为Na2O2时,质量为7.8g,产物质量在6.2g和7.8g之间时,两种产物都有,实际产物质量是7.8个,所以是Na2O2。
本题难度:简单
4、选择题 xgNa2O和ygNa2O2分别加入等质量的水中(水足量),结果得到等质量分数的溶液,则A与B关系正确的是
[? ]
A.x = y
B.x > y
C.x < y
D.无法确定
参考答案:C
本题解析:
本题难度:一般
5、选择题 在甲、乙、丙、丁四个烧杯中分别放入2.3 g Na、6.2 g Na2O、7.8 g Na2O2、4.0 g NaOH,然后各放入100 g水,搅拌,使固体完全溶解,则甲、乙、丙、丁四种溶液的质量分数的大小顺序是(?)
A.甲<乙<丙<丁
B.丁<甲<乙<丙
C.丁<甲<乙=丙
D.甲=丁<乙=丙
参考答案:C
本题解析:2Na? +? 2H2O====2NaOH+H2↑
46 36? 80? 2
2.3 g? 1.8 g? 4 g? 0.1 g
所以w(NaOH)=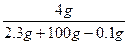 ×100%
×100%
Na2O + H2O====2NaOH
62 18? 80
6.2 g? 1.8 g? 8 g
所以w(NaOH)=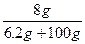 ×100%
×100%
2Na2O2+2H2O====4NaOH+O2↑
15636? 160? 32
7.8 g? 1.8 g? 8 g? 1.6 g
所以w(NaOH)=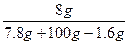 ×100%
×100%
而4.0 g NaOH溶于水所得溶液:w(NaOH)=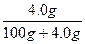 ×100%
×100%
本题难度:简单