微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (10分)使250 mL密度为1.1 g·cm-3、质量分数为24.5%的硫酸跟铁屑充分反应。计算:
(1)此硫酸中H2SO4的物质的量浓度。
(2)生成H2的体积(标准状况)。
(3)将生成的硫酸亚铁配制成400? mL溶液,此溶液中硫酸亚铁的物质的量浓度是多少?
参考答案:(1)2.75 mol·L-1
(2)15.4 L
(3)1.73 mol·L-1
本题解析:(1)c= ="2.75" mol·L-1。
="2.75" mol·L-1。
(2)n(H2SO4)="2.75" mol·L-1×0.250 L="0.688" mol
根据Fe+H2SO4====FeSO4+H2↑即知生成的氢气也为0.688 mol,在标准状况下的体积为0.688 mol×22.4 L·mol-1="15.4" L。
(3)从(2)中可以求出硫酸亚铁也是0.688 mol,则c(FeSO4)= ="1.73" mol·L-1。
="1.73" mol·L-1。
本题难度:简单
2、选择题 在冶金工业上,均不能用通常化学还原剂制得的金属组是( )。
A.Na,Mg,Al
B.Na,K,Zn,Fe
C.Zn,Fe,Cu,Ag
D.Mg,Al,Zn,Fe
参考答案:A
本题解析:根据金属的活动性顺序有下列冶炼方法:①从K~Al,用电解法;②Zn~Cu用还原剂(如H2,CO等)还原法;③Hg和Ag用加热分解法2HgO 2Hg+O2↑。
2Hg+O2↑。
本题难度:简单
3、选择题 已知酸性条件下有如下反应:2Cu+ Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
Cu2++Cu。由于反应温度不同,用氢气还原氧化铜时,可能产生Cu或Cu2O,两者都是红色固体。一同学对某次用氢气还原氧化铜实验所得的红色固体产物作了验证,实验操作和实验现象记录如下:
加入
试剂
| 稀硫酸
| 浓硫酸、
加热
| 稀硝酸
| 浓硝酸
|
实验
现象
| 红色固体和
蓝色溶液
| 无色气体
| 无色气体和
蓝色溶液
| 红棕色气体
和蓝色溶液
|
由此推出本次氢气还原氧化铜实验的产物是( )
A.Cu?B.一定有Cu,可能有Cu2O
C.Cu2O? D.一定有Cu2O,可能有Cu
参考答案:D
本题解析:由红色固体与稀硫酸反应的实验现象知该红色固体中一定含有Cu2O,又由于Cu2O、Cu分别与浓硫酸、稀硝酸、浓硝酸反应时产生的现象分别相同,故无法确定红色固体中是否有Cu。
本题难度:一般
4、选择题 血红蛋白的相对分子质量约为68000,已知其中含铁的质量分数为0.33%,则平均每个血红蛋白的分子中铁原子数约为?(?)
A.5
B.4
C.3
D.2.408×1024
参考答案:D
本题解析:略
本题难度:一般
5、实验题 (12分)两组同学对铁及其化合物的性质进行探究。
(1)一组同学用图1所示装置对铁与浓硫酸的反应进行实验。已知:
2Fe + 6H2SO4(浓) Fe2(SO4)3 + 3SO2↑+ 6H2O。请你参与探究并回答相关问题。
Fe2(SO4)3 + 3SO2↑+ 6H2O。请你参与探究并回答相关问题。
①检查装置气密性后,将过量的铁屑和一定量的浓硫酸放入烧瓶,塞紧橡皮塞,开始计时t1时开始加热,在铁屑表面逐渐产生气泡,当有大量气泡产生时,控制反应温度基本不变。甲同学将收集到的气体体积与时间的关系粗略地表示为图2。
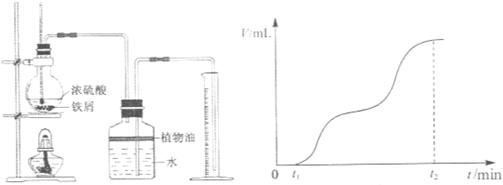
图1?图2
在0~t1时间段,铁屑表面没有气泡生成,说明铁在浓硫酸中发生了__________;t1~t2时间段,反应生成的气体是__________。
②t2时,取少量反应液,先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现红色褪去。同学们对红色褪去的原因提出各自的假设。乙同学的假设是:溶液中的+3价铁被氧化为更高的价态。你的另一种假设是__________;为了验证你的假设,请设计一种简便的实验方案__________。
(2)另一组同学对铁和稀硝酸的反应进行探究。他们用a mol Fe和含有b mol HNO3的稀硝酸进行实验,若HNO3只被还原成NO,且反应结束后溶液中含有Fe3+和Fe2+,则a/b的取值范围是__________;若反应结束后的溶液中n(Fe3+):n(Fe2+)=2:1,则的值为__________。
参考答案:.(1) ①钝化,SO2 ?
②?溶液中的SCN-被氧化,向褪色后的溶液中加FeCl3,若溶液不褪色则假设成立
(2)? 1/4 < a/b <3/8 ,9/32
本题解析:(1)①常温下铁在浓硫酸中发生钝化,所以得不到气体。随着温度的升高,fie被浓硫酸氧化生成SO2气体。
②氯水褪色,说明氯水被还原。因此除了铁离子还原之外,也可能是被溶液中的SCN-还原。
所以可以通过检验SCN-来鉴别,即向褪色后的溶液中加FeCl3,若溶液不褪色则假设成立。
(2)铁和硝酸的反应的方程式是Fe+4HNO3=Fe(NO3)3+NO↑+2H2O。如果铁过量,则方程式是3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。反应结束后溶液中含有Fe3+和Fe2+,则a/b的取值范围是 1/4 < a/b <3/8 ;反应结束后的溶液中n(Fe3+):n(Fe2+)=2:1,则生成硝酸铁和硝酸亚铁分别是2a/3mol和a/3mol,所以被还原的硝酸是(b-2a-2a/3)mol。根据电子的得失守恒可知,2a/3×3+a/3×2=(b-2a-2a/3)×3,解得a︰b=9︰32。
本题难度:一般