微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把少量废铁屑和铝粉的混合物溶于过量稀硫酸中(杂质不反应),过滤,除去杂质,在滤液中加入足量硝酸,再加入过量氨水,有沉淀生成。过滤,加热沉淀至质量不再发生变化,得到残渣。上述沉淀和残渣分别为(?)
A.Fe(OH)3 Al(OH)3 ;Fe2O3 Al2O3
B.Fe(OH)2 Al(OH)3 ;FeO Al2O3
C.Fe(OH)3 Fe(OH)2Al(OH)3 ;Fe3O4 Al2O3
D.Fe2O3 Al2O3;Fe(OH)2 Al(OH)3
参考答案:A
本题解析:溶解后为Fe2+和Al3+,加入硝酸后被氧化为Fe3+和Al3+,加入氨水后生成沉淀为Fe(OH)3 ?Al(OH)3 ;加热分解得到氧化物,故A正确。
本题难度:一般
2、实验题 (6分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。?应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。请回答该实验中的问题。

(1)写出该反应的反应方程式? ?。
?。
(2)圆底烧瓶中盛装的是水,该装置受热后的主要作用是??;烧瓶底部放置了几片碎瓷片,其作用是? ?。
(3)试管中收集气体是?,如果要在A处玻璃管处点燃该气体,则必须对该气体进行?。
参考答案:

本题解析:略
本题难度:一般
3、填空题 已知某混合金属粉末中,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
 仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol·L-1硫酸、2mol·L-2硝酸、2mol·NaOH溶液、20%KSCN溶液。
 完成以下实验探究过程:
完成以下实验探究过程:
 (1)提出假设:
(1)提出假设:
 假设1:该混合金属粉末中除铝外还含有?元素;
假设1:该混合金属粉末中除铝外还含有?元素;
 假设2:该混合金属粉末中除铝外还含有?元素;
假设2:该混合金属粉末中除铝外还含有?元素;
 假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
 (2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
(2)设计实验方案基于假设3,设计出实验方案(不要在答题卡上作答)。
 (3)实验过程
(3)实验过程
 根据(2)的实验方案,叙述实验操作、预期现象和结论。
根据(2)的实验方案,叙述实验操作、预期现象和结论。
 【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
【提示】Ⅰ.在答题卡上按以下方式作答,注意前后内容对应;
 Ⅱ.注意文字简洁,确保不超过答题卡空间。
Ⅱ.注意文字简洁,确保不超过答题卡空间。
参考答案:(1)Cu;Fe(顺序可交换)



 (3)①用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用?样品部分溶解,并有气体放出②往试管A的剩余固体中加过量稀硫酸,充分反应后,静置。取上层清液于试管B中,剩余固体备用?固体部分溶解,并有气体放出,溶液呈浅绿色,可能含铁③往试管B中加入少许稀硝酸,再滴加KSCN溶液?溶液先变黄色,加KSCN后显血红色,结合②可知,一定含铁④往②剩余固体中加入稀硝酸,再滴加NaOH溶液?固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,一定含铜。
(3)①用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用?样品部分溶解,并有气体放出②往试管A的剩余固体中加过量稀硫酸,充分反应后,静置。取上层清液于试管B中,剩余固体备用?固体部分溶解,并有气体放出,溶液呈浅绿色,可能含铁③往试管B中加入少许稀硝酸,再滴加KSCN溶液?溶液先变黄色,加KSCN后显血红色,结合②可知,一定含铁④往②剩余固体中加入稀硝酸,再滴加NaOH溶液?固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,一定含铜。
本题解析: 考查学生对元素化合物性质的掌握,考查学生对物质进行检验的实验技能和对实验室
考查学生对元素化合物性质的掌握,考查学生对物质进行检验的实验技能和对实验室
 常用仪器的主要用途和使用方法的了解,考查学生设计实验方案的能力和对常见物质进行分
常用仪器的主要用途和使用方法的了解,考查学生设计实验方案的能力和对常见物质进行分
 离、提纯和检验的能力,考查学生运用相关知识进行分析综合的方法以及运用正确的化学术
离、提纯和检验的能力,考查学生运用相关知识进行分析综合的方法以及运用正确的化学术
 语与文字等表达分析解决问题的过程,并做出合理解释的能力。本题考查学生对元素化合
语与文字等表达分析解决问题的过程,并做出合理解释的能力。本题考查学生对元素化合
 物性质的掌握,考查学生对物质进行检验的实验技能和对实验室常用仪器的主要用途和使用
物性质的掌握,考查学生对物质进行检验的实验技能和对实验室常用仪器的主要用途和使用
 方法的了解,考查学生设计实验方案的能力和对常见物质进行分离、提纯和检验的能力,考
方法的了解,考查学生设计实验方案的能力和对常见物质进行分离、提纯和检验的能力,考
 查学生运用相关知识进行分析综合的方法以及运用正确的化学术语与文字等表达分析解决
查学生运用相关知识进行分析综合的方法以及运用正确的化学术语与文字等表达分析解决
 问题的过程,并做出合理解释的能力。相对其它题目而言,本题文字量较大,要求学生能理
问题的过程,并做出合理解释的能力。相对其它题目而言,本题文字量较大,要求学生能理
 顺思路,准确描述。基本反应过程如下:加过量NaOH溶液溶解铝,过滤,加稀硫酸溶解
顺思路,准确描述。基本反应过程如下:加过量NaOH溶液溶解铝,过滤,加稀硫酸溶解
 铁,过滤,分别加硝酸氧化硫酸亚铁和固体铜。
铁,过滤,分别加硝酸氧化硫酸亚铁和固体铜。
本题难度:一般
4、选择题 Cu、Cu2O和CuO组成的混合物加入100 mL 0.6 mol/L HNO3溶液,恰好使混合物溶解,同时收集到224 mL NO气体(标准状况)。下列说法不正确的是
A.产物中硝酸铜的物质的量为0.025 mol
B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol
C.若混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量均为0.005 mol
D.混合物中Cu的物质的量的取值范围为0.005 mol<n(Cu)<0.015 mol
参考答案:B
本题解析:本题考查化学计算,意在考查考生的分析能力。根据氮元素守恒可知硝酸铜的物质的量为(0.1 L×0.6 mol/L-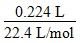 ?÷2)=0.025 mol,故A正确。若混合物中Cu的物质的量为0.005 mol,设Cu2O和CuO的物质的量分别为x mol、y mol,则0.005+2x+y=0.025(铜元素守恒),0.005×2+2x=0.01×3(电子守恒),解得x=0.01,y=0,故B错误。同理可得C正确。设混合物中Cu的物质的量为z mol,则z+2x+y=0.025,2z+2x=0.03,两式相减得z=y+0.005,据此有z>0.005;又由2z+2x=0.03推得z=0.015-x,据此有z<0.015,故有0.015>z>0.005,故D正确。
?÷2)=0.025 mol,故A正确。若混合物中Cu的物质的量为0.005 mol,设Cu2O和CuO的物质的量分别为x mol、y mol,则0.005+2x+y=0.025(铜元素守恒),0.005×2+2x=0.01×3(电子守恒),解得x=0.01,y=0,故B错误。同理可得C正确。设混合物中Cu的物质的量为z mol,则z+2x+y=0.025,2z+2x=0.03,两式相减得z=y+0.005,据此有z>0.005;又由2z+2x=0.03推得z=0.015-x,据此有z<0.015,故有0.015>z>0.005,故D正确。
本题难度:一般
5、实验题 (8分)化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用在空气中向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到整个过程的实验现象是______________,②加入NaOH溶液后,反应过程中发生反应的化学方程式是______________________和__________________。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有Fe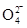 )。
)。
Ⅱ.SCN-的电子式为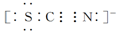
Ⅲ.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为Fe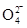 ,请写出该离子反应方程式________________________。
,请写出该离子反应方程式________________________。
②第二种假设是:__________________________。
参考答案:(8分)(1)①产生白色沉淀,迅速变为灰绿色,最终变成红褐色
②FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3
(2)①2Fe3++3Cl2+8H2O===2Fe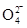 +6Cl-+16H+
+6Cl-+16H+
②SCN-被Cl2氧化 (方程式2分,其余每空1分)
本题解析:(1)由于生成的氢氧化亚铁极易被空气氧化生成氢氧化铁,所以实验现象是首先产生白色沉淀,然后迅速变为灰绿色,最终变成红褐色。有关反应的方程式是FeCl2+2NaOH===Fe(OH)2↓+2NaCl、4Fe(OH)2+O2+2H2O===4Fe(OH)3。
(2)①在反应铁元素的化合价从+3价升高到+6价,失去3个电子,而氯气只能得到2个电子,所以根据电子的得失守恒可知,反应的方程式是2Fe3++3Cl2+8H2O===2Fe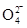 +6Cl-+16H+。
+6Cl-+16H+。
②根据SCN-的电子式可知,S和N元素的化合价分别是-2价和-3价,易被氯气氧化,因此红色也可以褪去。
本题难度:一般