微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题
A.9.6 g
B.6.4 g
C.3.2 g
D.1.6 g
参考答案:C
本题解析:由题意知,Cu、Ag与HNO3反应所得还原产物与O2作用溶于水后又变为HNO3,因此可以认为Cu、Ag所失电子最终被O2而非HNO3所得。
设Cu、Ag物质的量分别为x、y,则:

解得:x="0.050" mol,m(Cu)="64" g·mol-1×0.050 mol="3.2" g
本题难度:一般
2、选择题 高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能净水的处理剂。工业制备高铁酸钾的离子反应方程式为:Fe(OH)3+ C1O—+ OH—→FeO42—+C1—+ H2O(未配平)
下列有关说法不正确的是(?)
A.由上述反应可知,Fe(OH)3的氧化性强于FeO42—
B.高铁酸钾中铁显+6价
C.上述反应中氧化剂和还原剂的物质的量之比为3: 2
D.K2FeO4处理水时,不仅能消毒杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
参考答案:A
本题解析:A 错误,Fe(OH)3中铁是+3价,FeO42—中铁是+6价,所以,Fe(OH)3是还原剂,它的还原性强于FeO42—
B 正确。高铁酸钾中铁显+6价
C 正确,2Fe(OH)3+ 3C1O—+4 OH—=2FeO42—+3C1—+ 2H2O,故氧化剂和还原剂的物质的量之比为3: 2
D 正确,K2FeO4具有强的氧化性,能消毒杀菌,产物Fe(OH)3胶体,有吸附性,能吸附水中的悬浮杂质。
本题难度:一般
3、实验题 实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),其过程如下:
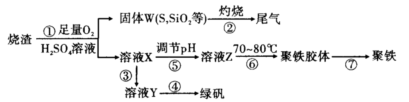
(1)过程①中,FeS和O2、H2SO4反应的化学方程式为?。
(2)过程②中产生的尾气会对大气造成污染,可选用下列试剂中的?吸收。
a.浓H2SO4? b.蒸馏水? c.NaOH溶液? d.浓硝酸
(3)过程③中,需要加入的物质名称是?
(4)过程④的实验操作是?
(5)过程⑥中,将溶液Z加热到70~80℃,目的是?。
(6)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700 g;②将样品溶于足量盐酸后,加人足量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为?。
参考答案:
(1)4FeS+3O2+6H2SO4=2Fe2(SO4)3+6H2O+4S(2分)
(2)c(2分)?(3)铁(2分)
(4)蒸发(浓缩)、(冷却)结晶、过滤、洗涤(4分,浓缩、冷却不写可以不扣分)
(5)促进Fe3+的水解(2分)
(6)31.11%(3分)
本题解析:
(1)根据固体W的成分中存在S,推出FeS和O2、H2SO4发生氧化还原反应,FeS做还原剂,O2作氧化剂,产物有Fe2(SO4)3、S、H2O。
(2)污染物是SO2,用碱液吸收。
(3)溶液X中的铁是Fe3+,绿矾中的铁为Fe2+,故应加入Fe粉,将Fe3+还原为Fe2+。
(4)对能形成结晶水合物的盐溶液不能采取直接蒸干的办法制取晶体。
(5)升高温度,促进Fe3+的水解。 (6)③得到的沉淀是BaSO4,n(BaSO4) =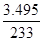 =0.015mol,根据聚铁主要成分为[Fe(OH)SO4] n,推出n(Fe3+)=0.015mol,则m(Fe3+)=0.84g,铁元素的质量分数:ω(Fe)=(0.84g/2.700g)×100%=31.11%。
=0.015mol,根据聚铁主要成分为[Fe(OH)SO4] n,推出n(Fe3+)=0.015mol,则m(Fe3+)=0.84g,铁元素的质量分数:ω(Fe)=(0.84g/2.700g)×100%=31.11%。
本题难度:一般
4、简答题 试样A是由氧化铁和氧化铜组成.取质量相等的两份试样按下图进行实验,最后得到不溶物F和溶液G,不溶物F加入盐酸能放出气体.

(1)写出反应①中氧化铁与铝粉反应的反应方程式:______.
(2)溶液G中的溶质是______.
(3)写出反应②有关的两个离子方程式:______;______.
参考答案:依据流程图分析可知,试样A为氧化铜和氧化铁,加入过量铝粉高温反应,生成铁和氧化铝,固体B为Al、Al2O3、CuO、Fe;固体B加入过量氢氧化钠溶液为Al、Al2O3和氢氧化钠溶液反应生成偏铝酸钠溶液,过滤得到溶液D为偏铝酸钠溶液,固体E为CuO、Fe,溶液C为FeCl3,CuCl2溶液,最后得到不溶物F和溶液G,不溶物F加入盐酸能放出气体证明含有铁,说明铁过量,溶液G中溶质为FeCl2,
(1)反应①中氧化铁与铝粉反应的反应方程式为:Fe2O3+2Al高温.Al2O3+2Fe,
故答案为:Fe2O3+2Al高温.Al2O3+2Fe;
(2)结合分析过程可知G为氯化亚铁,故答案为:FeCl2;
(3)反应②有关的两个离子方程式是铝和氢氧化钠溶液反应,反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2↑;氧化铝和氢氧化钠溶液反应,反应的离子方程式为:
Al2O3+2OH-=2AlO2-+H2O,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;Al2O3+2OH-=2AlO2-+H2O.
本题解析:
本题难度:一般
5、填空题 在FeSO4溶液中滴加入少量KSCN溶液,溶液颜色?,
再滴入几滴氯水,溶液颜色?,因为有?生成。
实验室配制的FeCl2溶液由于各种原因很容易变质,为了防止其水解,我们经常在里面加入____;为了防止其被氧化,经常加入_____,相应的化学反应方程式为_________________。_______
参考答案:

本题解析:略
本题难度:简单