微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、判断题 (4分)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
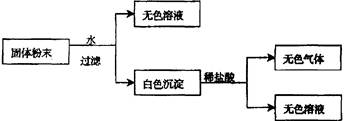
从实验可以判断,该固体粉末中
(1)一定不含有?。
(2)写出无色气体的分子式?。
参考答案:(1)CuSO4;(2) CO2
本题解析:根据图可知,固体粉末溶于水得到无色溶液,所以一定没有CuSO4,得到的白色沉淀能全部溶于稀盐酸,所以一定是CaCO3,产生的气体是CO2。
点评:本题考查学生分析问题的能力,简单基础。
本题难度:简单
2、填空题 中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体.(图中部分产物和反应条件已略去)
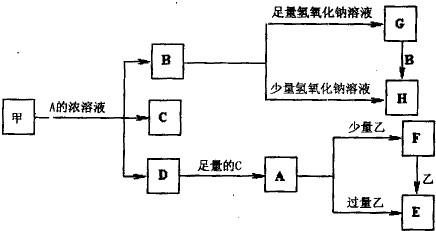
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式______.
(2)将等体积等浓度的G溶液和H溶液混合后得到的溶液中的离子浓度大小关系为______.
(3)除去G固体中含有H杂质采用的方法是______.
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝色的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)______.
(5)写出向E溶液中加入少量稀硫酸后反应的离子方程式______.将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为______.
(6)确定E中阳离子实验的方法为______.
参考答案:D是红棕色气体,说明D是二氧化氮;甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,则B是二氧化碳,C是水;二氧化碳和足量氢氧化钠溶液反应生成碳酸钠和水,而二氧化碳和少量氢氧化钠溶液反应生成碳酸氢钠和水,所以G是碳酸钠,而H是碳酸氢钠;二氧化氮和水反应生成硝酸;由硝酸和少量乙反应生成F,和过量乙反应生成E,F和乙又可生成E,可知乙为金属铁,而F为硝酸铁,E为硝酸亚铁,
(1)D是红棕色气体,说明D是二氧化氮;由甲是黑色非金属单质,且和A的浓溶液反应生成二氧化氮,说明甲是碳,A溶液是浓硝酸,则B是二氧化碳,C是水,反应的化学方程式为:C+4HNO3(浓)?△?.??CO2↑+4NO2↑+2H2O;故答案为:C+4HNO3(浓)?△?.??CO2↑+4NO2↑+2H2O;
(2)碳酸钠和碳酸氢钠的混合液中,碳酸根的水解程度大于碳酸氢根的水解程度,溶液显示碱性,离子浓度大小关系是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(3)碳酸氢钠受热分解为碳酸钠、水以及二氧化碳,而碳酸钠受热稳定,可以用加热法除去碳酸钠中的碳酸氢钠,故答案为:加热;
(4)能使湿润的红色石蕊试纸变蓝色的气体反应是氨气,硝酸和氨气反应生成硝酸铵,由于铵根水解导致溶液显示酸性,故答案为:NH4++H2O

NH3?H2O+H+;
(5)向硝酸亚铁中加入硫酸,相等于存在硝酸,硝酸可以将亚铁离子氧化,实质是:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,硝酸亚铁易被氧气氧化为硝酸铁,三价铁水解生成氢氧化铁,受热分解为氧化铁,故答案为:3Fe2++NO3-+4H+=3?Fe3++NO↑+2H2O;Fe2O3;
(6)亚铁离子易被氧化为三价铁,三价铁遇到硫氰酸钾显示红色,亚铁离子的检验方法:先加入KSCN溶液无变化再加入氯水(或盐酸等)溶液变红色,故答案为:先加入KSCN溶液无变化,再加入氯水(或盐酸等)溶液变红色.
本题解析:
本题难度:简单
3、填空题 (8分)下图中各物质均为中学化学中常见的物质,它们之间有如图转化关系。其中A、C均为金属单质;D的焰色反应呈黄色;C与水反应除了生成D,还能生成自然界最轻的气体;E是一种氢氧化物,它既能跟NaOH反应又能跟盐酸反应。(反应过程中生成的水及其他产物已略去)

请回答以下问题:
(1)B是_________,E是_________。(填化学式)
(2)写出E转化为G的离子方程式?。
(3)写出C和水反应的化学方程式??。
参考答案:
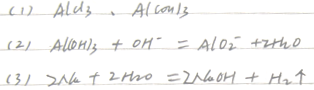
本题解析:略
本题难度:一般
4、填空题 现有A、B、C、D、E五种物质,A、B?是两种常见的单质,C、D、E是三种常见的化合物,它们之间的相互转化关系如图示.
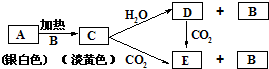
(1)写出A、B、C、D、E的化学式:
A______?B______?C______D______?E______
(2)写出C转化为D的化学方程式:______写出D转化为E的离子方程式:______.
参考答案:根据A→B的颜色变化,可知A为Na,C为Na2O2,B为O2,则D为NaOH,E为Na2CO3,则
(1)由以上分析可知A为Na,B为O2,C为Na2O2,D为NaOH,E为Na2CO3,故答案为:Na;O2;Na2O2;NaOH;Na2CO3;
(2)Na2O2和水反应生成NaOH和O2,反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,
CO2和NaOH反应的离子方程式为CO2+2OH-=CO32-+H2O,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;CO2+2OH-=CO32-+H2O.
本题解析:
本题难度:一般
5、简答题 A、B、C、D是中学化学常见的四种物质,它们的转化关系如下:A+B=C+D
(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,则A中非氧元素的气态氢化物M的电子式为______;分子的稳定性B______M(填“>”、“<”或“=”).
(2)若A、D是两种单质,B是黑色有磁性的氧化物,B与盐酸反应生成溶液N,检验N溶液中低价金属阳离子的方法是______.将D的粉末加入溶液N中,当有28gD完全溶解时,该反应转移的电子是______mol.
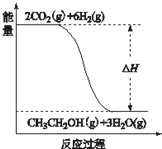
(3)若A、B、C、D发生反应:2CO2(g)+6H2(g)═CH3CH2OH(g)+3H2O(g),根据如图所示信息,
①反应是______反应(填“放热”或“吸热”),判断依据是______.
②若△H=aKJ/mol,当消耗标况下5.6LCO2时的反应热△H=______KJ/mol.
③在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是______(填字母序号).
A.生成1molCH3CH2OH的同时,生成3molH2OB.容器中各组份的物质的量浓度不随时间而变化
C.容器中混合气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化.
参考答案:(1)若A、B、C都是非金属氧化物,且C在空气中易变成A,A、C为同种元素氧化物,应是二氧化氮与水反应生成硝酸与NO,A为NO2、B为H2O、C为NO、D为硝酸,则A中非氧元素的气态氢化物M为NH3,NH3分子中N原子与H原子之间形成1对共用电子对,其电子式为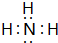 ,非金属性O>N,故氢化物稳定性H2O>NH3,
,非金属性O>N,故氢化物稳定性H2O>NH3,
故答案为: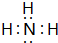 ;>;
;>;
(2)B是黑色有磁性的氧化物,B为Fe3O4,若A、D是两种单质,为置换反应,故D为Fe,Fe3O4与盐酸反应生成FeCl3、FeCl2溶液,取少许溶液于试管中,加入K3Fe(CN)6溶液,若出现蓝色沉淀则说明有Fe2+,将Fe加入上述溶液中,发生反应Fe+2Fe3+=3Fe2+,28gFe的物质的量=28g56g/mol=0.5mol,反应中Fe元素化合价由0价升高为+2,故转移电子物质的量=0.5mol×2=1mol,
故答案为:取少许溶液于试管中,加入K3Fe(CN)6溶液,若出现蓝色沉淀则说明有Fe2+;1;
(3)①由图可知,反应物总能量大于生成物总能量,该反应为放热反应,
故答案为:放热;反应物总能量大于生成物总能量;
②5.6L二氧化碳的物质的量=5.6L22.4L/mol=0.25mol,图中△H=aKJ/mol,表示2mol二氧化碳反应时的反应热,故5.6LCO2时的反应热△H=aKJ/mol×0.25mol2mol=0.125aKJ/mol,
故答案为:0.125a;
③A.生成1molCH3CH2OH的同时,生成3molH2O,反应始终按此比例进行,不能说明到达平衡,故A错误;
B.平衡时,反应混合物各组分的物质的量浓度不随时间而变化,故B正确;
C.容器的容积不变,混合气体的总质量不变,混合气体密度始终不变,密度不随时间而变化,不能说明到达平衡,故C错误;
D.正反应为气体物质的量减小的反应,容器中气体的分子总数不随时间而变化,说明到达平衡,故D正确,
故选BD.
本题解析:
本题难度:一般