微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 根据以下各物质间的转化关系回答有关问题.
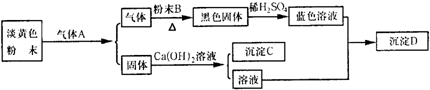
(1)C、D的化学式依次为______、______.
(2)A的电子式为______,它属于______(填“极性”或“非极性”)分子.
(3)淡黄色粉末与气体A反应的化学方程式为______;黑色固体与稀硫酸反应的离子方程式为______.
参考答案:固体可与氢氧化钙溶液反应生成沉淀,则该固体应为碳酸盐,所以淡黄色粉末为Na2O2,气体A为CO2,二者反应生成Na2CO3和O2,黑色固体与稀硫酸反应生成蓝色溶液,应为硫酸铜溶液,则粉末B为Cu,黑色固体为CuO,得到的沉淀D为Cu(OH)2,则
(1)由以上分析可知,C为CaCO3,D为Cu(OH)2,故答案为:CaCO3;Cu(OH)2;
(2)A为CO2,为共价化合物,电子式为
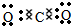
,结构对称,为非极性分子,故答案为:
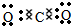
;?非极性;
(3)Na2O2在CO2中燃烧生成Na2CO3和O2,反应的化学方程式为2Na2O2+2CO2═2Na2CO3+O2,CuO不溶于水,与酸反应生成Cu2+和水,反应的离子方程式为?CuO+2H+═Cu2++H2O,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;?CuO+2H+═Cu2++H2O.
本题解析:
本题难度:一般
2、推断题 A是自然界存在最广泛的IIA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:

请回答下列问题:
(1)A与水反应的化学方程式为_________,E与水反应的化学方程式为_____;
(2)F的化学式为_________,G和D的电子式分别为_________和__________;
(3)D与H反应可能生成的盐有_____________ (填化学式);
(4)实际生产中,可由F为原料制备单质A,简述一种制备方法______________。
参考答案:(1)Ca+2H2O=Ca(OH)2+H2↑;NaH+H2O=NaOH+H2↑
(2)CaCO3;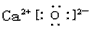 ?;
?;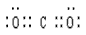
(3)Na2CO3,NaHCO3
(4)将CaCO3与盐酸反应转化为CaCl2,然后电解熔融的CaCl2固体就制得单质钙。
本题解析:
本题难度:一般
3、填空题 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示。又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是应用最广泛的金属。②乙在甲中燃烧发出苍白色火焰,E的水溶液呈黄色。回答下列问题:

(1)A与B可反应,产物中阳离子的结构式为?。
(2)A与B的沸点比较,较高的是?(写化学式)。
(3)E的水溶液可使KI淀粉溶液变蓝,写出该反应的离子方程式:?。
(4)工业上可由B与丁反应制取C,写出该反应的化学方程式:?。
(5)将甲和E同时加(通)入强碱性溶液中,可制得一种高效杀菌、净水剂(其中含由+6价戊元素形成的带2个单位负电荷的含氧酸根离子),请写出该反应的离子方程式:?。
(6)用以上金属戊作电极,利用如图装置,可以模拟金属的电化学防护。若X为碳棒,为减缓戊的腐蚀,开关K应置于?处。若X为锌,开关K置于M处,该电化学防护法称为?。
参考答案:(1)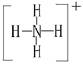 (2)NH3
(2)NH3
(3)2Fe3++2I- 2Fe2++I2
2Fe2++I2
(4)4NH3+5O2 4NO+6H2O
4NO+6H2O
(5)2Fe3++3Cl2+16OH- 2Fe
2Fe +6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH-
+6Cl-+8H2O[或2Fe(OH3+3Cl2+10OH- 2Fe
2Fe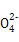 +6Cl-+8H2O]
+6Cl-+8H2O]
(6)N 牺牲阳极的阴极保护法
本题解析:根据图示和②乙在甲中燃烧发出苍白色火焰,则甲为Cl2,乙为H2,A为HCl。又因E的水溶液呈黄色,则E中应含Fe3+,即戊为Fe,E为FeCl3。又因丙、丁是空气的主要成分,即为N2和O2中的一种,再根据转化关系图,丁与戊(Fe)反应,故丁为O2,则丙为N2,B为NH3,C为NO,D为Fe2O3或Fe3O4。(1)A(HCl)与B(NH3)反应生成NH4Cl,N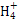 的结构式为
的结构式为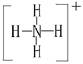 。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I-
。(2)由于NH3分子间存在氢键,故NH3的沸点比HCl的高。(3)Fe3+具有氧化性,I-具有还原性,两者混合可发生反应:2Fe3++2I- 2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2
2Fe2++I2。(4)工业上制取NO是将NH3催化氧化得到,其反应为:4NH3+5O2 4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe
4NO+6H2O。(5)由题中信息可知反应物有Cl2、Fe3+和OH-,生成物有Fe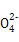 ,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH-
,根据氧化还原反应的规律和原子守恒可推知生成物中还有Cl-和H2O,故反应的离子方程式为:2Fe3++3Cl2+16OH- 2Fe
2Fe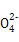 +6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH-
+6Cl-+8H2O或2Fe(OH)3+3Cl2+10OH- 2Fe
2Fe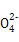 +6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
+6Cl-+8H2O。(6)若X为碳棒,为减缓铁的腐蚀,则K应置于N处;若X为Zn,K置于M处,构成原电池,此法称为牺牲阳极的阴极保护法。
本题难度:一般
4、填空题 有关元素X、Y、Z、W的信息如下:

请回答下列问题:
(1) Y的单质在空气 中充分燃烧所得氧化物的电子式________________
中充分燃烧所得氧化物的电子式________________
(2) X、Y、W的简单离子的半径由大到小的是_______________ (写离子符号)
(3) 向淀粉碘化钾溶液中滴加几滴 的浓溶液,现象为______________ ,
的浓溶液,现象为______________ ,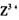 基态离子的电子排布式为?
基态离子的电子排布式为?
(4) 以 溶液为原料制取无水
溶液为原料制取无水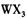 ,主要操作包括加热浓缩、冷却结晶、过滤,先制得
,主要操作包括加热浓缩、冷却结晶、过滤,先制得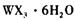 晶体,然后在条件下加热
晶体,然后在条件下加热 晶体,能进一步制取无水
晶体,能进一步制取无水 .其原因是(结合离子方程式简要说明)? _____________________________________________
.其原因是(结合离子方程式简要说明)? _____________________________________________
参考答案:(12分)

本题解析:略
本题难度:一般
5、简答题 选做题:图表示某些化工生产的流程(部分反应条件和产物略去):

(1)反应I需在500℃进行,其主要原因是______.
(2)H转化为N的过程中,需要不断补充空气,其原因是______.
(3)写出反应Ⅲ的化学方程式______.
(4)工业上,向析出K的母液中通氨气,加入细小食盐颗粒,冷却后可析出副产品.通入氨气的作用是______(填序号).
a.增大NH4+的浓度,使J更多地析出
b.使K更多地析出
c.使K转化为M,提高析出的J的纯度
(5)写出上述流程所涉及的化学工业的名称______.
参考答案:液态空气蒸馏主要得到O2和N2,焦炭和水蒸气在高温下反应生成CO和H2,二者得到的气体B、C在催化剂条件下能发生反应,则应为N2和H2的反应,生成的气体为NH3,所以,A为O2,B为N2,C为H2,D为CO,E为NH3,NH3和O2在催化剂条件下发生氧化还原反应生成NO,NO与反应生成NO2,进而与水反应生成,所以,G为NO,H为NO2,I为HNO3,L为NH4NO3,CO和O2反应生成CO2,CO2、NaCl和NH3反应生成NaHCO3,为侯氏制碱法的主要反应,NaHCO3加热分解生成Na2CO3,则F为CO2,
J为NH4Cl,K为NaHCO3,M为Na2CO3;
(1)反应I是工业合成氨气的反应,需在500~℃进行,其主要原因是此温度下催化剂活性最高;故答案为:此温度下催化剂活性最高;
(2)H转化为N的过程中是二氧化氮和水反应生成硝酸和一氧化氮的反应,反应是化学平衡,需要不断补充空气使一氧化氮气体不断转化为二氧化氮,提高原料的利用率,故答案为:使一氧化氮气体不断转化为二氧化氮,提高原料的利用率;
(3)反应Ⅲ是候氏制碱法的反应原理,氨化的饱和食盐水中通入二氧化碳生成碳酸氢钠晶体和氯化铵,反应的化学方程式为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
故答案为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl;
(4)工业上,向析出K的母液为氯化铵中通氨气,加入细小食盐颗粒,冷却后可析出副产品J氯化铵,通入氨气的作用是增大铵根离子浓度使氯化铵晶体析出,氨气溶于水后生成氨水,氨水电离成铵根,增大铵根的浓度有利于氯化铵的析出来分析;同时通入氨气使溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠,可以提高氯化铵的纯度;故答案为:ac;
(5)上述流程所涉及的化学工业的名称为:工业合成氨、氨气的催化氧化、侯德榜制碱法;故答案为:工业合成氨、氨气的催化氧化、侯德榜制碱法;
本题解析:
本题难度:一般