微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 工业上用纯净的消石灰与氯气反应制取漂白粉,已知漂白粉的有效成分为55.17%,求消石灰的利用率.
参考答案:原混合物中NaCl为3.23g,NaBr为2.06g.
本题解析:由于NaCl不参与反应,故引起固体物质质量减少的原因是NaBr NaCl.
NaCl.
设原混合物中NaBr的质量为m(NaBr) g
2NaBr? +? Cl2="===2NaCl?" +? Br2?Δm(固)
2×103 g? 2×58.85? 89g
m(NaBr) g? (5.29-4.40)g
 =
=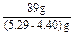
解之得:m(NaBr)=2.06g
故原混合物中NaCl的质量为:5.29g-2.06g=3.23g
本题难度:简单
2、简答题 为了探究HClO的漂白性,某同学设计了如下的实验.
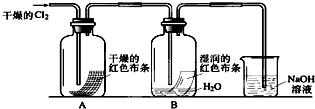
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是______;从集气瓶B中湿润的红色布条的现象可得出的结论是______,其中发生的反应的化学方程式为______.
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是______.
(3)烧杯中溶液所起的作用是______,烧杯中所发生反应的化学方程式为______.
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2mol?L-1的NaOH溶液的体积至少应为______mL.
参考答案:(1)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO,
故答案为:干燥的氯气没有漂白性;氯水具有漂白性;Cl2+H2O=HCl+HClO;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,故答案为:证明盐酸是否有漂白性;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气;Cl2+2NaOH=NaCl+NaClO+H2O
(4)4分钟时n(Cl2)=1.12L×422.4L/mol=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)=0.4mol2mol/L=0.2L=200mL,
故答案为:200.
本题解析:
本题难度:一般
3、实验题 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。所用仪器如图:

(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接__;__接__。(2分)
(2)装置中,饱和食盐水的作用是______________;NaOH溶液的作用是____________。(4分)
(3)写出下列化学反应的方程式。
①气体发生装置中进行的反应:________________________________________。(2分)
②NaOH溶液中发生的反应:__________________________________________ 。(2分)
参考答案:(1)E C D A B H G F?(2)除去氯气中的HCl杂质;吸收过量的氯气
(3)①MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑?②2NaOH+Cl2=NaCl+NaClO+H2O
MnCl2+2H2O+Cl2↑?②2NaOH+Cl2=NaCl+NaClO+H2O
本题解析:(1)二氧化锰在加热的条件下氧化浓盐酸生成氯气,由于浓盐酸易挥发,因此生成的氯气中含有氯化氢杂质,所以需要首先通过饱和的食盐水除去氯气中的氯化氢杂质。由于要收集干燥的氯气,所以还需要再次通过浓硫酸干燥氯气。氯气的密度大于空气的,因此需要向上排空气法收集,即长口进,短口出。又因为氯气有毒,所以最后还需要进行尾气处理,即将尾气通入到氢氧化钠溶液中吸收剩余的氯气,以防止污染空气,因此正确的连接顺序是E、C、D、A、B、H、G、F。
(2)根据以上分析可知,饱和食盐水的作用是除去氯气中的HCl杂质;NaOH溶液的作用是吸收过量的氯气。
(3)①实验室制取氯气的方程式为MnO2+4HCl(浓) ?MnCl2+2H2O+Cl2↑。
?MnCl2+2H2O+Cl2↑。
②氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O。
本题难度:一般
4、选择题 碘(ICl)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,能与许多非金属单质反应生成相应卤化物,能与水反应等。其与水反应的方程式为ICl+H2O HCl+HIO。 下列关于ICl的叙述中不正确的是(?)
HCl+HIO。 下列关于ICl的叙述中不正确的是(?)
A.ICl是一种有色物质
B.在许多反应中ICl是强氧化剂
C.在ICl与水的反应中,它既是氧化剂又是还原剂
D.与NaOH溶液反应生成的产物中有NaIO和NaCl
参考答案:C
本题解析:A、碘(ICl)的化学性质与卤素单质相似,而卤素单质都是有颜色,因此ICl也是一种有色物质。
B、ICl中碘元素的化合价为+1价,可降低为0价,具有强氧化性,可做氧化剂。
C、ICl+H2O HCl+HIO中没有元素的化合价发生变化,故该反应不是氧化还原反应,此叙述不正确。
HCl+HIO中没有元素的化合价发生变化,故该反应不是氧化还原反应,此叙述不正确。
D、由反应ICl+H2O HCl+HIO可看出,与NaOH反应后的产物应为NaIO和NaCl,正确。故答案为C。
HCl+HIO可看出,与NaOH反应后的产物应为NaIO和NaCl,正确。故答案为C。
点评:本题考查氧化还原反应,属于基础题,也是高考的常见考点。考生在复习备考中,应牢牢把握住基本概念,只有掌握了基本概念,才能很好的解答此类基础题型。
本题难度:简单
5、填空题 硫酸、硝酸和盐酸既是重要的化工原料也是化学实验室里必备的试剂。
(1)常温下,可用铝槽车装运浓硫酸,这是因为浓硫酸具有?性;硝酸应保存在棕色试剂瓶中,这是因为硝酸具有?性;敞口放置的浓盐酸浓度会减小,这是因为盐酸具有?性。
(2)①在100 mL 18 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积为13.44 L,则参加反应的铜片的质量为?(选填序号);
a.115.2 g? b.76.8 g? c.57.6 g? d.38.4 g
②若使上述①中反应剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程式:?。
(3)工业制盐酸是以电解饱和氯化钠溶液为基础进行的,该电解过程中阳极的电极反应式为:?。
参考答案:(1)(3分)强氧化?不稳定?挥发
(2)(3分)d(1分)? 3Cu + 8H+ + 2NO3—=3Cu2+ + 2NO↑+ 4H2O(2分)
(3)(2分)2Cl— — 2e—=Cl2↑
本题解析:(1)由于浓硫酸具有强氧化性,在常温下能使铝发生钝化,所以常温下,可用铝槽车装运浓硫酸;浓硝酸见光易分解生成NO2、氧气和水,所以硝酸应保存在棕色试剂瓶中;由于浓盐酸易挥发,所以敞口放置的浓盐酸浓度会减小。
(2)①标准状况下13.44L气体的物质的量=13.44L÷22.4L/mol=0.6mol,根据方程式2H2SO4(浓)+Cu  CuSO4+2H2O+SO2↑可知,参加反应的铜的物质的量是0.6mol,质量=0.6mol×64g/mol=38.4g,答案选d。
CuSO4+2H2O+SO2↑可知,参加反应的铜的物质的量是0.6mol,质量=0.6mol×64g/mol=38.4g,答案选d。
②由于随着反应的进行,浓硫酸的浓度逐渐降低。而铜与稀硫酸不反应,因此反应中硫酸过量。又因为在酸性条件下硝酸盐具有强氧化性,因此能氧化剩余的铜,反应的离子方程式为3Cu + 8H+ + 2NO3—=3Cu2+ + 2NO↑+ 4H2O。
(3)电解池中阳极失去电子,发生氧化反应。因此惰性电极电解饱和食盐水时阳极是氯离子放电,电极反应式为2Cl— — 2e—=Cl2↑。
本题难度:一般