微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某实验室的尾气中含有较多的氯气,有毒,要吸收这些尾气,下列试剂最适合的是( )
A.饱和的石灰水
B.饱和的食盐水
C.自来水
D.氢氧化钠溶液
参考答案:A、虽氯气能与饱和石灰水反应,但相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,其吸收效果不如烧碱溶液,故A错误;
B、饱和食盐水中氯离子浓度达到最大,抑制氯气的溶解,则吸收效果最不好,故B错误;
C、自来水中含有氯离子,将抑制氯气的溶解,且吸收效果不好,故C错误;
D、因氯气能与烧碱反应,且相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,则烧碱溶液的吸收效果好,故D正确;
故选D.
本题解析:
本题难度:简单
2、选择题 下列对氯气的说法不正确的是( )
A.氯气是由舍勒发现的
B.干燥的氯气不能使有色布条褪色
C.氯气不能支持燃烧
D.用氯气消毒自来水不如用臭氧消毒自来水好
参考答案:A. 1774年,瑞典化学家舍勒用二氧化锰和浓盐酸反应制得氯气,故A正确;
B.氯气不具有漂白性,则氯气不能使干燥有色布条褪色,故B正确;
C.任何发光,发热的剧烈的氧化反应叫燃烧,氢气和氯气发生H2+Cl2点燃.2HCl,所以氯气可以支持氢气燃烧,故C错误;
D.氯气与水反应Cl2+H2O?HCl+HClO,氯水中含有H+、Cl2、HClO、ClO-、Cl-等微粒,具有强氯化性的HClO、ClO-,可以杀死细菌、病毒,同时引入副产物H+、Cl2、Cl-,臭氧用作水消毒时,不存在二次污染问题,还兼有脱色、除味等功效,用氯气消毒自来水不如用臭氧消毒自来水好,故D正确;
故选C.
本题解析:
本题难度:一般
3、选择题 某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是(?)?
A.石蕊
B.硝酸银
C.氢氧化钠
D.氯化铝
参考答案:D
本题解析:自来水一般用氯气消毒,所以自来水具有弱酸性和强氧化性,因此选项A、B、C都是会发生变化的,而氯化铝不会发生变化,答案选D。
点评:氯气溶于水即得到氯水,氯水中存在H+、OH-、Cl-、ClO-、Cl2、HClO、H2O,据此可以判断氯水参与反应时所起的作用。
本题难度:一般
4、简答题 氯水中含有多种成分,因而具有多重性质.根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间

反应,且氯水足量).
(1)能证明氯水具有漂白性的是______(填“a”、“b”、“c”或“d”).
(2)c过程中的现象是______.
(3)a过程中的化学方程式为______.
? b过程中的离子方程式为______.
参考答案:(1)氯水中的HClO有强氧化性,一般在应用其漂白时,HClO的强氧化性将有色物质氧化成无色物质,本题中氯水能使石蕊试液先变红,后褪色,故答案为:d;
(2)氯水中有Cl-,加入AgNO3溶液有白色沉淀生成,生成AgCl沉淀,故答案为:有白色沉淀生成;
(3)Cl2是新制氯水的主要成分,具有强氧化性,与FeCl2发生氧化还原反应,
反应的化学方程式为2FeCl2 +Cl2 ═2FeCl3,氯水中含有HCl和HClO,具有酸性,与CO32-反应生成二氧化碳气体,反应的离子方程式为CO32-+2H+=CO2↑+H2O,故答案为:2FeCl2 +Cl2 ═2FeCl3;CO32-+2H+=CO2↑+H2O.
本题解析:
本题难度:一般
5、简答题 为了探究HClO的漂白性,某同学设计了如下的实验.
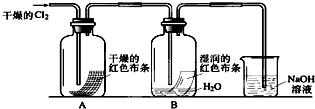
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是______;从集气瓶B中湿润的红色布条的现象可得出的结论是______,其中发生的反应的化学方程式为______.
(2)为了确证是HClO使湿润的红色布条褪色,你认为还应增加的实验是______.
(3)烧杯中溶液所起的作用是______,烧杯中所发生反应的化学方程式为______.
(4)为保证实验安全,当氯气以每分钟1.12L(标准状况)的流速匀速通入时,若实验需耗时4分钟,小烧杯中盛2mol?L-1的NaOH溶液的体积至少应为______mL.
参考答案:(1)氯气不能使干燥的有色布条褪色,干燥的氯气没有漂白性,氯气能使湿润的有色布条褪色,因为氯气和水反应生成的次氯酸具有漂白性,原理方程式为:Cl2+H2O=HCl+HClO,
故答案为:干燥的氯气没有漂白性;氯水具有漂白性;Cl2+H2O=HCl+HClO;
(2)氯气和水反应的产物是盐酸和次氯酸,要证明谁有漂白性,得做两个实验:证明盐酸是否有漂白性和证明次氯酸是否有漂白性的实验,故答案为:证明盐酸是否有漂白性;
(3)氯气有毒,会造成空气污染,可以用氢氧化钠来吸收,反应生成氯化钠、次氯酸钠和水,
故答案为:吸收多余的氯气;Cl2+2NaOH=NaCl+NaClO+H2O
(4)4分钟时n(Cl2)=1.12L×422.4L/mol=0.2mol,根据反应方程式Cl2+2HaOH=NaCl+NaClO+H2O可知,
需要n(NaOH)=0.4mol,
所以V(NaOH)=0.4mol2mol/L=0.2L=200mL,
故答案为:200.
本题解析:
本题难度:一般