微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 第29届奥运会期间,作为马拉松领跑车和电视拍摄车的汽车,装着“绿色心脏”——质子交换膜燃料电池,其工作原理如图所示。下列叙述中正确的是

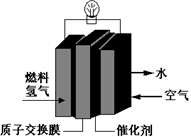
A.通入空气的电极发生氧化反应
B.通入氢气的电极为正极
C.正极的电极反应式为:O2+4H+-4e-==2H2O
D.总反应式为:O2+2H2==2H2O
参考答案:D
本题解析:
专题:电化学专题.
分析:在燃料电池中,通入燃料的电极是负极,该极上发生失电子的氧化反应,通入氧气的电极是正极,该极上发生得电子的还原反应,总反应即为燃料燃烧的化学方程式.
解答:解:A、根据燃料电池的电极反应规律:通入空气(含有氧气)的电极是正极,发生还原反应,故A错误; B、根据燃料电池的电极反应规律:通入燃料氢气的电极是负极,故B错误;C、通入氧气的电极是正极,该极上发生得电子的还原反应,在酸性环境下,电极反应为:O2+4H++4e-═2H2O,故C错误; D、在燃料电池中,根据燃料电池的电极反应规律:总反应即为燃料燃烧的化学方程式,即O2+2H2═2H2O,故D正确,选D。
点评:本题考查学生燃料电池的工作原理知识,可以根据所学知识进行回答,难度不大.
本题难度:简单
2、选择题 某种氢氧燃料电池的电解液为KOH溶液。下列有关电池的叙述不正确的是
A.负极反应式 为:H2+2OH-—2e-==2H2O
B.工作一段时间后,电解液中的KOH的物质的量不变
C.该燃料电池的总反应方程式为:2H2+O2==2H2O
D.用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.1mol电子转移
参考答案:D
本题解析:负极反应式为:H2+2OH-—2e-==2H2O工作一段时间后,电解液中的KOH的物质的量不变。该燃料电池的总反应方程式为:2H2+O2==2H2O,用该电池电解CuCl2溶液,产生2.24LCl2(标准状况)时,有0.2mol电子转移.
本题难度:简单
3、填空题 (1)可利用Cu+2FeCl3=CuCl2+2FeCl2反应,设计一个原电池.
写出电极反应方程式:负极:______正极:______
(2)航天技术上使用的一种电池,它具有高能、轻便、不污染环境等优点.用Pt做电极,KOH溶液做电解液,因其反应与氢氧燃烧相似,2H2+O2=2H2O,故称为氢氧燃烧电池.请写出各电极的电极反应.
负极:______正极:______.
参考答案:(1)由反应“Cu+2FeCl3=CuCl2+2FeCl2”可知,反应中铜被氧化,应为原电池负极,失电子而被氧化,电极反应为Cu-2e-=Cu2+,正极应为活泼性比Cu弱的金属或非金属材料,Fe3+在正极得到电子而被还原,电极反应式为
Fe3++e-=Fe2+,电解质溶液为FeCl3.
故答案为:负极:Cu-2e-═Cu2+正极Fe3++e-=Fe2+.
(2)该反应中氢气失电子被氧化,氢气失电子生成氢离子,氢离子和溶液中的氢氧根离子生成水,所以电极反应式为2H2+4OH--4e-=4H2O.
氧气得电子被还原,氧气得电子和水反应生成氢氧根离子,所以电极反应式为O2+2H2O+4e-=4OH-.
故答案为:2H2+4OH--4e-=4H2O;O2+2H2O+4e-=4OH-.
本题解析:
本题难度:简单
4、选择题 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是

[? ]
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体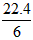 L
L
参考答案:B
本题解析:
本题难度:一般
5、选择题 人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2↑,Ag2O+H2O+2e-==2Ag+2OH-。据此判断锌是(?)?
A.负极,并被氧化
B.正极,并被还原
C.负极,并被还原
D.正极,并被氧化
参考答案:A
本题解析:略
本题难度:简单