微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用价电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,也可推测键角大小,下列判断正确的是
A.CS2是V形分子
B.SnBr2键角大于120°
C.BF3是三角锥形分子
D.NH4+键角等于109.5°
参考答案:D
本题解析:A、CS2分子的结构与二氧化碳相同,均是直线形结构,A不正确;B、SnBr2中Sn的价层电子对数=2,且不含有孤对电子,所以早自习结构,键角是120°,B不正确;C、BF3是平面三角形结构,C不正确;D、NH4+是正四面体形结构,键角等于109.5°,D正确,答案选D。
本题难度:一般
2、选择题 以下分子或离子的结构为正四面体且键与键之间夹角为109°28′的是( )
①CH4? ? ②NH4+? ③CH3Cl? ④P4 ? ⑤金刚石
A.①②④
B.①②③④⑤
C.①②
D.①②⑤
参考答案:D
本题解析:①CH4分子中C原子是sp3型杂化,杂化轨道全部用于成键,碳原子连接4个相同的原子,为正四面体构型,键角是109°28′;②NH4+离子中N原子形成成4个σ键,N原子是sp3型杂化,杂化轨道全部用于成键,N原子连接4个相同的原子,为正四面体构型,键角是109°28′;③CH3Cl分子中C原子是sp3型杂化,杂化轨道全部用于成键,但C原子连接的4个原子不完全相同,为四面体构型,但不是正四面体;④P4?分子中4个P原子位于正四面体4个的顶点上,P4?分子的空间构型是正四面体构型,但键角是60°;⑤金刚石中C原子是sp3型杂化,形成4个σ键,C原子连接4个相同的原子,为正四面体构型,键角是109°28′,所以正确的答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题,题目难度不。该题的关键是掌握价层电子对互斥理论与杂化轨道理论,注意P4(白磷)分子的键角为60°而不是109°28′。
本题难度:一般
3、填空题 “洁净煤技术”研究在世界上相当普遍,科研人员通过向煤气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达12 500~16 000 kJ·m-3的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。已知:
C(s)+O2(g) CO2(g) ΔH1=-393.5 kJ·mol-1①
CO2(g) ΔH1=-393.5 kJ·mol-1①
2H2(g)+O2(g) 2H2O(g) ΔH2=-483.6 kJ·mol-1②
2H2O(g) ΔH2=-483.6 kJ·mol-1②
C(s)+H2O(g) CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
CO(g)+H2(g) ΔH3=+131.3 kJ·mol-1③
则反应CO(g)+H2(g)+O2(g) H2O(g)+CO2(g) ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
H2O(g)+CO2(g) ΔH= kJ·mol-1。标准状况下的煤炭气(CO、H2)33.6 L与氧气完全反应生成CO2和H2O,反应过程中转移 mol e-。
参考答案:-524.8 3
本题解析:①-③,得CO(g)+H2(g)+O2(g) H2O(g)+CO2(g) ΔH=-393.5 kJ·mol-1-131.3 kJ·mol-1=-524.8 kJ·mol-1;由反应知道CO、H2是等体积,因此CO、H2的体积都为16.8 L,其物质的量分别为0.75 mol、0.75 mol,CO、H2共转移的电子的物质的量为3 mol。
H2O(g)+CO2(g) ΔH=-393.5 kJ·mol-1-131.3 kJ·mol-1=-524.8 kJ·mol-1;由反应知道CO、H2是等体积,因此CO、H2的体积都为16.8 L,其物质的量分别为0.75 mol、0.75 mol,CO、H2共转移的电子的物质的量为3 mol。
考点:化学反应热的计算
本题难度:一般
4、选择题 已知:① 1molH2分子中化学键断裂时需要吸收436kJ的能量;② 1molCl2分子中化学键断裂时需要吸收
243kJ的能量;③ 由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。下列叙述正确的是
[? ]
A.1个氢分子和1个氯分子反应生成1个氯化氢分子,反应的△H=-183kJ·mol-1
B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=183kJ·mol-1
C.氢气与氯气反应生成2mol氯化氢气体,反应的△H=-183kJ·mol-1
D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=-183kJ·mol-1
参考答案:C
本题解析:
本题难度:一般
5、填空题 (14分)运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应
 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
参考答案:(每空2分,共14分)
(1)-247KJ·mol-1 K12·K2·K3
(2)a·c
(3) = K=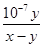 mol·L-1
mol·L-1
(4)碱性 O2+2H2O+4e-=4OH-
本题解析:(1)根据盖斯定律得3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
CH3OCH3(g) +CO2(g) △H=①×2+②+③=△Hl×2+△H2+△H3=-247KJ·mol-1,平衡常数K= K12·K2·K3
(2)a、容器体积固定,3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
CH3OCH3(g) +CO2(g)是反应前后气体压强发生改变的可逆反应,所以体系压强保持不变时达平衡状态,正确;b、容器体积固定,根据质量守恒定律,得气体的密度始终不变,所以不能作为平衡状态到达的标志,错误;c、反应开始时,CO和H2的物质的量一直减少,当CO和H2的物质的量保持不变,不再减少时证明已达平衡状态,正确;d、CO的消耗速率任何状态都不等于CO2的生成速率,错误,答案选ac;
(3)根据电荷守恒定律,盐酸与氨水混合后的溶液显中性,则c(H+)=c(OH-),c(Cl-)+ c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+);在25℃下,中性溶液中c(H+)= c(OH-)=1×10-7mol/L,若盐酸与氨水的浓度相等,则等体积混合后生成氯化铵溶液显酸性,而实际溶液显中性,说明氨水的浓度大于盐酸的浓度,氨水过量,设二者的体积均为1L,与盐酸反应完剩余氨水的物质的量(x-y)mol,一水合氨的浓度为(x-y)/2mol/L,c(NH4+)=c(Cl-)=y/2mol/L,则氨水的电离平衡常数K= c(OH-)c(NH4+)/ c(NH3·H2O)= 1×10-7mol/L×y/2mol/L/(x-y)/2mol/L=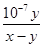 mol·L-1,
mol·L-1,
(4)根据电池反应式为:4NH3+3O2 =2N2+6H2O,判断氨气发生氧化反应,氧气发生还原反应,氨气失电子成为氮气和氢离子,所以电解质溶液应显碱性,产物中才能生成水;因为电解质溶液为碱性,所以正极是氧气的还原反应,氧气得电子与水结合生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-
考点:考查盖斯定律的应用 ,化学平衡状态的判断,化学平衡常数的计算,原电池反应原理的应用
本题难度:困难