微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 在3升的密闭容器中,充入6molX(g)和4molY(g),在一定条件下发生应:
4X(g)+3Y(g)  ?2Q(g)+nR(g), 2min内达平衡,此时容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小了1/3。
?2Q(g)+nR(g), 2min内达平衡,此时容器内温度不变,混合气体的压强比原来增加了5%,X的浓度减小了1/3。
(1)试求n值? (2)2min内Y的反应速率?
参考答案:(1)n=6;(2)0.25mol/(L·min)
本题解析:考查可逆反应的有关计算。
4X(g)+3Y(g)  ?2Q(g)+nR(g)
?2Q(g)+nR(g)
起始量(mol)? 6? 4? 0? 0
转化量(mol)? 2? 1.5? 1? 0.5n
平衡量(mol)? 4? 2.5? 1? 0.5n
由于混合气体的压强比原来增加了5%
所以有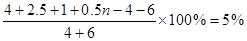
解得n=6
2min内Y的反应速率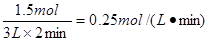
本题难度:一般
2、填空题 (本题14分)工业上用CO生产燃料甲醇。一定条件下发生反应:

(1)图l是反应时CO和CH3OH(g)的浓度随时问变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率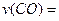 ??;
??;
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表使用催化剂后的能量变化。该反应的焓变是?(选填“△H<0”或“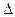 H>0”)反应,写出反应的热化学方程式?;选择适宜的催化剂,?(填“能”或“不能”)改变该反应的反应热;
H>0”)反应,写出反应的热化学方程式?;选择适宜的催化剂,?(填“能”或“不能”)改变该反应的反应热;
(3)该反应平衡常数K的表 达式为?,温度升高,平衡常数K??(填“增大”、“不变”或“减小”);
达式为?,温度升高,平衡常数K??(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使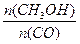 增大的?。?
增大的?。?
a.升高温度;? b.充入He气
c.再充入1molCO和2mol H2? d.使用催化剂
参考答案:
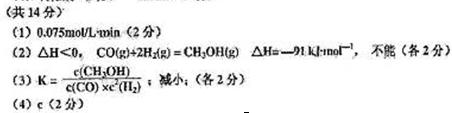
本题解析:略
本题难度:一般
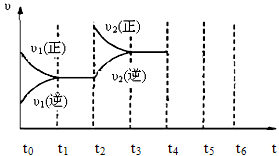
3、选择题 一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是(?)
2C(g)+D(g);DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是(?)
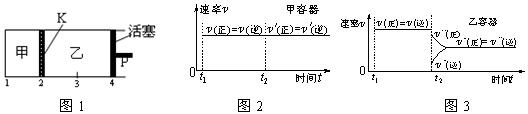
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
参考答案:D
本题解析:略
本题难度:简单
4、填空题 (12分)(每空3分)碘钨灯具有使用寿命长、节能环保等优点。一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:
W(s)+ I2(g) ?WI2(g)ΔH<0
?WI2(g)ΔH<0
为模拟上述反应,在450℃时向一体积为2L的恒容密闭容器中加入0.1mol碘单质和足量的钨,2min后反应达到平衡,测得碘蒸气浓度为0.005 mol·L-1。请回答下列问题:
(1)前两分钟内碘蒸气的反应速率为???。
(2)能够说明上述反应已经达到平衡状态的有???。
A.I2与WI2的浓度相等
B.容器内气体压强不再变化
C.W的质量不再变化
D.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等